|
《动脉粥样硬化》 > 第六章 脂蛋白受体
第一节 低密度脂蛋白受体Schneider等于1982年从牛肾上腺分离出LDL受体,以后又分离出编码牛LDL受体羧基末端1/3氨基酸的cDNA,并初步阐明了牛LDL受体cDNA,推导出人LDL受体的氨基酸序列。
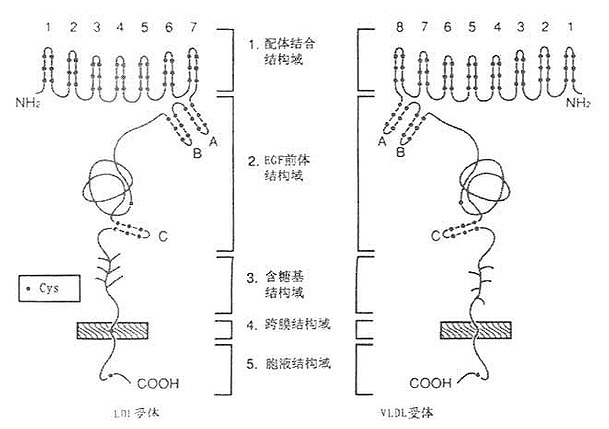
一、LDL受体结构LDL受体是一种多机能蛋白,由836个氨基酸组成的36面体结构蛋白,分子量约115kD。由五种不同的区域构成(见图6-1),各区域有其独特的功能。
图6-1 LDL受体与VLDL受体结构 1.配体结合结构域配体结合结构域由292个氨基酸残基组成,其中共有47个半胱氨基酸,含有七个由40个氨基酸残基组成的与补体CB、Cq类似的重复序列,每个重复系列中有6个Cys残基,所有42个Cys残基均已构成二硫键,重复序列2、3、6、7是结合LDL所必需的,其中任何一种发生突变,均使受体丧失结合LDL的能力。重复序列5则与结合β-VLDL有关,若该序列突变时,该受体结合β-VLDL的能力丧失60%。该受体不仅能结合LDL,还能结合VLDL、β-VLDL和VLDL残粒;它不仅能识别ApoB100,也可识别ApoE的脂蛋白。ApoE、B100为LDL受体的配体,因此,LDL受体又称为ApoB100,E受体。 2.EGF前体结构域 约由400个氨基酸残基组成的肽段,有5个重复序列,每个重复序列包括25个氨基酸残基。EGF前体结构域与小鼠上皮细胞生长因子(epidermal growth factor,EGF)前躯体有同源性,这一区域因此而得名,Mutagenisis等在体外实验证实,这个区域的肽段,属于细胞膜外结构蛋白,起着支撑作用。 3.含糖基结构域 由58个氨基酸残基组成,是紧靠细胞膜面的肽段,由18个丝氨酸或苏氨酸构成0-连接糖链,对LDL受体起着支撑作用。 4.跨膜结构域 由22个氨基酸残基组成,富含疏水氨基酸残基,属于跨膜蛋白,起着固系于细胞膜中的抛锚作用。这个区域缺陷,影响受体的细胞外分泌。 5.胞液结构域 位于细胞膜的胞浆侧,由50个氨基酸残基组成,C-末端位于胞浆并“深埋”于胞浆之中。
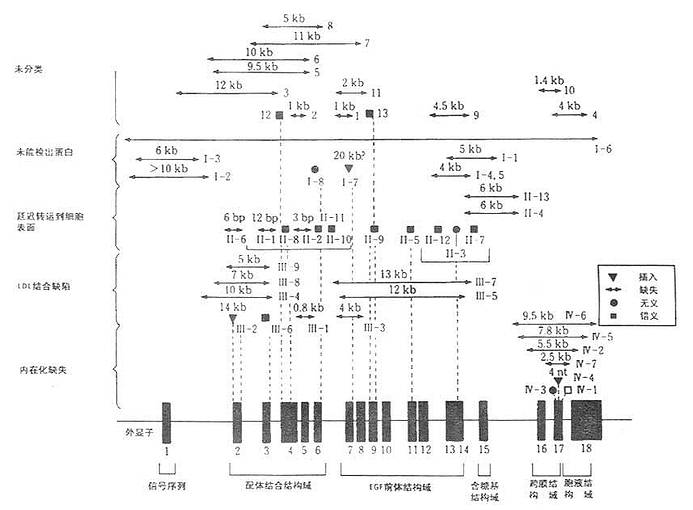
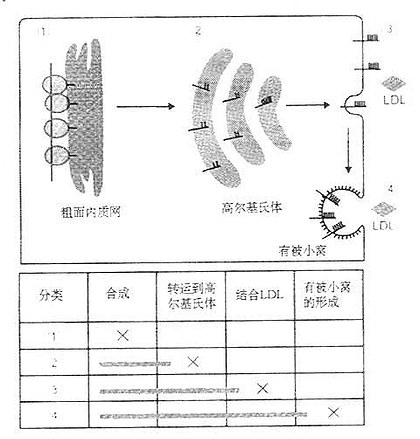
二、LDL受体基因结构人LDL受体基因长度45kD,由18个外显子和17个内含子组成共长达2535bp。LDL受体基因如图6-2所示。 外显子1编码短的5'侧序列及信号肽。内含子1在信号肽远端2个氨基酸处中断编码序列。配体结合域中的7个由40个氨基酸残基组成的重复序列中,第Ⅰ、Ⅱ、Ⅴ、Ⅵ、Ⅶ残基序列均由各自的外显子编码,Ⅲ、Ⅳ和Ⅴ则由同一个外显子编码。 EGF前体结构域由外显子7至14编码其蛋白的290~690氨基酸残基。外显子15则编码LDL受体C末端的50个氨基酸。 LDL受体基因突变时可引起多种遗传疾病,典型遗传病有定族性高胆固醇(FH)。LDL受体基因突变种类包括基因大片段的缺失或插入或仅有1个碱基的改变而导致形成错误或无意义的密码(见图6-2)。 通过基因水平分析,LDL受体基因突变不外乎下列几种类型:①一类是因基因突变使LDL受体蛋白无法检出或其活性丧失,这种突变涉及到mRNA转录水平变异。如外显子1中缺6~10kb或外显子13~15kb缺失4~5kb;②另一类是因突变使分子量为120kD和ECG前驱体结构域抑制通过小胞体进入高尔基氏体的转送作用;③第三种是突变结果使LDL受体的结合LDL的能力降低;④第四种是受体结合LDL后不能内移,这种突变点在外显子16~18kb,即编码跨膜结构域的一段基因。LDL受体的四种级别变异类型如图6-3所示。
图6-2 LDL受体基因结构及其家族性高胆固醇血症的基因突变和受体蛋白变异 (引自 KajinamiK. Mabuchi H, Michishita I et al.Arteriosclerosis 8.187.1988)
图6-3 LDL受体的生物合成与四种级别的变异类型 (源自Brown MS, et al.1986)
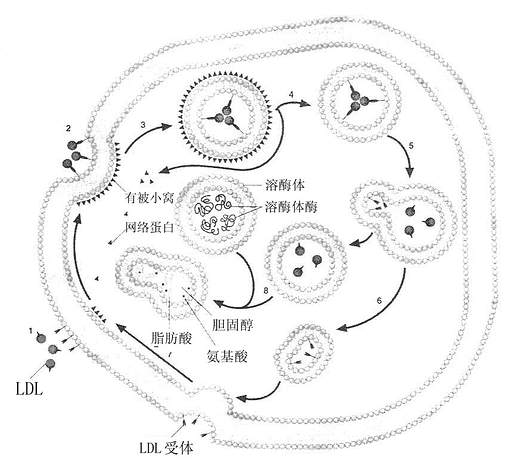
三、LDL受体功能LDL受体广泛分布于肝脏、动脉壁平滑肌细胞、肾上腺皮质细胞、血管内皮细胞、淋巴细胞、单核细胞、巨噬细胞,各组织或细胞的LDL受体活性差别很大。 含ApoB100的脂蛋白可以与LDL受体以高亲和力结合转运到肝脏,肠道分泌的ApoB48不是LDL受体配体。所以肝脏不能清除完整的CM。 LDL或其他含ApoB100,E的脂蛋白如VLDL、β-VLDL均可与LDL受体结合,内吞入细胞使其获得脂类,主要是胆固醇,这种代谢过程称为LDL受体途径(LDl receptor pathway),该途径依赖于LDL受体介导的细胞膜吞饮作用完成,如图6-3所示。当血浆中LDL与细胞膜上有被区域(coated region)的LDL受体结合(第1步),使其出现有被小窝(coated pit)(第2步),并从膜上分离形成有被小泡(coated vesicles)(第3步),其上的网格蛋白(clathrin)解聚脱落,再结合到膜上(第4步),其内的pH值降低,使受体与LDL解离(第5步),LDL受体重新回到膜上进行下一次循环(第6、7步)。有被小泡与溶酶融合后,LDL经溶酶体酶作用,胆固醇酯水解成游离胆固醇和脂肪酸,甘油三酯水解成脂肪酸,载膜蛋白B100水解成氨基酸,见图6-4。LDL被溶酶体水解形成的游离胆固醇再进入胞浆的代谢库,供细胞膜等膜结构利用。胞内游离胆固醇在调节细胞胆固醇代谢上具有重要作用:若胞内浓度升高,可能出现下述几种情况:①抑制HCGCoA还原酶,以减少自身的胆固醇合成;②抑制LDL受体基因的表达,减少LDL受体的合成,从而减少LDL的摄取,这种LDL受体减少的调节过程称为下调(down regulation);③激活内质网酰基CoA胆固醇酰基转移酶(acyl-Coa cholesterolacyltransferase,ACAT),使游离胆固醇在胞浆内酯化成胆固醇酯贮存,以供细胞的需要。经上述三方面的变化,用以控制细胞内胆固醇含量处于正常动态平衡状态。血浆中胆固醇主要存在于LDL中,而65%~70%的LDL是依赖肝细胞的LDL受体清除。肝脏的LDL受体还影响LDL的合成速率及VLDL代谢。曾经认为人VLDL几乎全部在血循环中转变为LDL,LDL再被肝外组织摄取,现在经大鼠和兔实验研究表明,VLDL仅有15%以下转变为LDL,人则有<50%的VLDL转变为LDL,大部分VLDL是以VLDL或VLDL残粒的形式被肝脏摄取。VLDL残粒与肝脏受体的亲和力比VLDL大很多,VLDL中虽有少量ApoE,因含有丰富的ApoC,可掩盖ApoE,而阻碍其与肝脏的ApoE、E受体结合,因VLDL转变成VLDL残粒时,随着甘油三酯水解而丧失ApoC,暴露出ApoE,因此,VLDL残粒被肝清除的速率比VLDL快。VLDL残粒大部分被肝脏清除,一小部分在肝脂酶作用下水解除去甘油三酯而转变成LDL。LDL受体还在乳糜微粒代谢中起有一定作用。由于乳糜微粒中的ApoB48不能识别ApoB100,E受体。所以肝脏不能清除完整的乳糜微粒。但是血管中乳糜微粒被脂蛋白脂肪酶水解去除其大部分甘油三酯核心后,同时丧失部分ApoC、A,生成乳糜微粒残粒除去了阻碍ApoE与受体结合的因素,故可迅速被肝脏清除。LDL约有一半是通过LDL受体,另一半通过LDL受体相关蛋白进行代谢,其半寿期短, 总之,LDL受体主要功能是通过摄取胆固醇进入细胞内,用于细胞增殖和固醇类激素及胆汁酸盐的合成等。
图6-4 LDL受体胞吞作用示意图
…… 第二节 肝脂酶 第三节 卵磷脂胆固醇酯酰转移酶 第四节 HMGCoA还原酶 (脂类代谢有关酶类)参考文献 第六章 脂蛋白受体 第一节 低密度脂蛋白受体(当前页) 第二节 极低密度脂蛋白受体 第三节 清道夫受体 (脂蛋白受体)参考文献 第七章 脂类代谢有关的特殊蛋白质 …… |