|
《临床生物化学》 > 第四章 血浆蛋白及其代谢紊乱
第二节 载脂蛋白脂蛋白中的蛋白部分称为载脂蛋白(apolipoprotein/apoprotein,Apo)。载脂蛋白在脂蛋白代谢中具有重要的生理功能。Apo构成并稳定脂蛋白的结构,修饰并影响与脂蛋白代谢有关的酶的活性。作为脂蛋白受体的配体,参与脂蛋白与细胞表面脂蛋白受体的结合及其代谢过程。
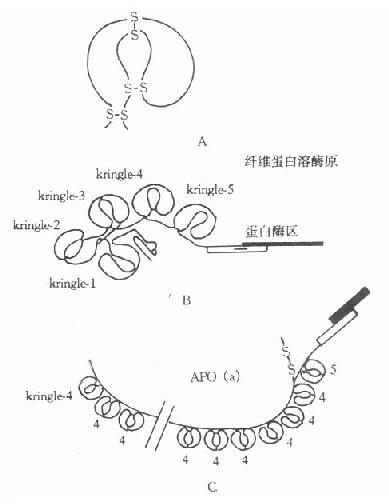
一、载脂蛋白组成与结构特点及生理功用Apo种类很多,一般分为5-7类,其氨基酸序列大多数已阐明,Apo种类的命名是按1972年Alaupovic建议的命名方法,用英文字母顺序编码,即ABC顺,每一类还有亚类。 (一)载脂蛋白A族 ApoA可分为ApoAⅠ,AⅡ,AⅣ。ApoAⅠ和AⅡ大部分分布在HDL中,是HDL的主要载脂蛋白。 1.ApoAⅠApoAⅠ是ApoA族最多的一种组份,先后从人HDL中分离纯化得到ApoAⅠ,并阐明了ApoAⅠ的氨基酸序列,也预测了其二级结构的要点。人成熟的ApoAⅠ由243个氨基酸残基组成,是单一多肽链,分子量为28.3ku。人及大鼠、猴、兔、牛、鸭、树鼷等动物的ApoAⅠ已分离纯化。人和其他种属的ApoAⅠ的氨基末端为Asp,羧基末端为Gln,其分子中不含半胱氨酸和异亮氨酸。经等电点聚焦电泳证实,人和动物的ApoAⅠ都是不均一的,有10种不同的亚组份,至少有6种多态性。 目前所知,ApoAⅠ的氨基酸残基的排列有其自身的特征:①极性氨基酸残基含量较多,并以1,2或1,4相反离子对的形式排列,即Glu-Arg、Glu-Lys或Asp=lys、Asp-Arg。②疏水氨基酸残基一对对地出现在1,2或1,4反离子对的附近,因此很容易形成特有的双性螺旋二级结构。极性与非极性氨基酸残基排列的方式是载脂蛋白的一个共性。由疏水氨基酸残基组成螺旋的非极性面,由带电荷亲水的氨基酸残基组成螺旋极性面,故称为双性螺旋。与一般蛋白质的α-螺旋不同,这种双性螺旋既有亲脂的一面又有亲水的一面。ApoAⅠ富含双性螺旋结构,对于维持其正常的生理功能是非常重要的。 ApoAⅠ主要存在于HDL中,在HDL3中ApoAⅠ占载脂蛋白的65%,在HDL2中ApoAⅠ占载脂蛋白的62%,在CM、VLDL和LDL中也有少量存在。血浆中呈现β迁移率的一种β-HDL,其内80%为ApoAⅠ。 Ⅰ的生理功能有:①组成载脂蛋白并维持其结构的稳定性与完整性。实验表明,纯化的ApoAⅠ在水溶液中可以自发地和脂类结合。用CNBr法将ApoAⅠ裂解成四个肽段,发现仅有羧基末端的肽段可自发和磷脂结合。后来进一步确认这一段是ApoAⅠ224-242段,这一段既可维持双性螺旋的结构,又可以维持和脂质结合所具备的疏水性。②ApoAⅠ可以激活卵磷脂胆固醇酰基转移酶(LCAT)的活性。已经证实,ApoAⅠ是通过激活LCAT,再催化胆固醇酯化。ApoAⅠ肽段Ⅲ(肽段116-151)是激活作用的中心。③ApoAⅠ可作为HDL受体的配体,含ApoAⅠ脂蛋白可以和转铁蛋白及铜蓝蛋白形成大分子复合物以运输铁和铜离子。 Ⅰ由肝和小肠合成,血浆中生物半寿期为45天。 2.ApoAⅡApoAⅡ是HDL中第二种含量多的载脂蛋白,在HDL2中占载脂蛋白的15%,在HDL3中占载脂蛋白25%,在CM中占载脂蛋白的7%-10%,VLDL中也存在少量。到1985年,ApoAⅡ蛋白质的氨基酸序列,cDNA序列及基因序列均已阐明。ApoAⅡ是由两条多肽链的77个氨基酸残基组成。ApoAⅡ在不加还原剂的SDS-PAGE中测出分子量是17ku,在人血浆中以二聚体形式存在。ApoAⅡ的单体分子量为8.7ku。ApoAⅡ蛋白的C端氨基酸残基为谷氨酸,N端为吡咯烷酮酸,缺乏组氨酸、精氨酸及色氨酸。ApoAⅡ有多态性存在。 ApoAⅡ生理功能是:①维持HDL结构,ApoAⅡ肽段12-31和肽段50-77具有与磷脂结合的能力。经二级结构分析认为,残基17-30和51-62形成的双性螺旋结构是人ApoAⅡ与脂质结合的分子基础。②激活肝脂酶,用以水解CM和VLDL中的TG和PL。还有报道,ApoAⅡ可抑制LCAT活性。 ApoAⅡ由肝和小肠合成。人血浆中的ApoAⅡ生物半寿期为4.4天。 3.ApoAⅣ最先从大鼠HDL和CM中发现载脂蛋白AⅣ,以后证实人血浆中也有ApoAⅣ存在,主要分布于密度大于1.211g/ml部分。成熟ApoAⅣ由376个氨基酸残基组成。经SDS-PAGE确认大鼠和人ApoAⅣ分子量为44-46ku。人和大鼠氨基酸组成相似,是一种糖蛋白,含有6%的碳水化合物,其中甘露醇占1.8%,半乳糖占1.55%,N-乙酰葡萄糖胺占1.55%,唾液酸占1.1%。ApoAⅣ有多态性存在,生物半寿期为10小时。 ApoAⅣ生理功能目前尚不完全清楚,据推测ApoAⅣ在胆固醇逆向转运过程中起着重要作用。体外的ApoAⅣ可以促进LCAT的胆固醇酯化反应,并认为是LCAT的激活剂。ApoAⅣ由肝和小肠合成,并有五种多态型。 (二)Apob族 体外实验表明,ApoB是难溶于水的蛋白质。目前所知,ApoB族可分为两个亚类,即ApoB48和ApoB100。ApoB主要成分是B100,其次为B48,其它形式的如ApoB75、ApoB41、ApoB36等均为ApoB100的不同降解产物。 1.ApoB100ApoB是单链糖蛋白,分子量为51ku,主要在肝,少数在小肠合成。ApoB100由4536个氨基酸残基组成。包括27个(或24)氨基酸信号肽和4536个氨基酸残基的成熟单体蛋白。1986年ApoB100的全部氨基酸残基排列顺序及结构已经阐明。当年已测出ApoB100的cDNA序列,ApoB100分子中含有25个Cys残基。其中有11个Cys残基集中分布在前面500氨基酸组成区域,形成链内二硫键,所以N端高度交联成典型球形结构。Cys残基通过硫酯键与软脂酸、硬脂酸相结合,使ApoB牢固地连接着脂质成分。ApoB100中,对脂类结合十分必要的区域结构在203-2506和4002-4527氨基酸残基之间。两个结构区域重复出现两性亲脂α-螺旋区段;另有一种结合脂质的重要结构是含疏水和亲水性氨基酸交替排列的两性亲脂β-折叠结构。这种结构分布在整个分子序列中,但集中于四个富含脯氨酸区,这种富含脯氨酸的重复序列是ApoB所特有的,使ApoB能够将磷脂侧链深埋其间并使之紧密结合。由于ApoB的两性α-螺旋和富含脯氨酸的疏水肽以及可被脂酰化的Cys残基形成的特殊结构,在VLDL和LDL从分泌到被清除的整个过程中,使α-螺旋能够与单层极性脂牢固地结合,从而使其不在脂蛋白分子间转换,这是与其他载脂蛋白不同之处。 ApoB100的生理功能有:①合成装配和分泌富含甘油三酯的VLDL;②是LDL的结构蛋白。③LDL受体的配体,并可调节LDL从血浆中的清除速率。 2.ApoB48ApoB48因分子量是ApoB100的48%而得名。存在于CM中,不与其他脂蛋白分子交换。ApoB48在小肠合成,是组装CM所必需的载脂蛋白。小肠细胞分泌CM后进入淋巴液,并通过胸导管再进入血液循环,再分布到毛细血管的内皮细胞,主要是骨骼肌体和脂肪组织的内皮细胞,脂肪酶可水解CM中甘油三酯的80%-90%,剩下的脂蛋白颗粒则称为CM残粒,尓后送到肝,被肝脂酶进一步代谢,最后被能够识别ApoE的残粒受体摄取。该残粒受体是LDL受体,还是与LDL受体相关的蛋白或其他蛋白质,目前尚不清楚。 人血浆中ApoB48生物半寿期仅5-10分钟,分解速度很快,血浆中的浓度很低,约相当于ApoB100的0.1%。经SDS-PAGE电泳染色在VLDL组分中可检出痕量的ApoB48。进食丰富的脂肪后,ApoB48/ApoB100比值明显增加。 (三)ApoC族 ApoC是目前所知载脂蛋白中分子量最小的一类。最先从VLDL中分离出一种含有少量磷脂的低分子量载脂蛋白,并命名为载脂蛋白C。此后双在HDL中发现有ApoC,并进一步确认ApoC有三种亚型,即ApocⅠ、Ⅱ、Ⅲ。 Apoc是由57个氨基酸残基组成的单一多肽链,其序列已测出,不含半胱氨酸、组氨酸和酪氨酸。分子量为6625u。人ApoCⅠ二级结构中有55%α-螺旋结构,极易与磷脂结合,它是LCAT的激活剂。 ApoCⅡ是由79个氨基酸残基组成单一多肽链,氨基酸顺序已测出,分子量为9110u,有两种多态型,pⅠ分别为4.86和4.69。不含半胱氨酸和丝氨酸,其二级结构的α-螺旋约占23%。ApoCⅡ可激活多种来源的脂蛋白脂肪酶(LPL),其结构中第55-78位氨基酸残基是维持其对LPL激活作用的最短的必须区域。羧基端43-50位氨基酸残基为α-螺旋结构的脂质结合区。 ApoCⅢ由79个氨基酸残基组成单一多肽链,由于第74位苏氨酸残基所带唾液酸个数不同,又可分为ApoCⅢ0、CⅢ1、CⅢ2三个亚类,也是其多态性,等电点分别为5.02,4.82和4.62。ApoCⅢ氨基酸序列已测出,分子量为8764u,其二级结构在不同状态下,α-螺旋约占22%-54%不等。ApoCⅢ的α-螺旋结构极易与磷脂结合。 ApoC族生理功能有:①同磷脂相互作用,维持脂蛋白结构:在溶液中呈特殊的立体双性离子,带负电荷的酸性氨基酸与磷脂带正电荷的基团作用,具有很强的磷脂结合活性。由于与磷脂的相互作用,使ApoC族的α-螺旋结构增加,而磷脂的单个酯酰链的运动则受到限制,从而影响磷脂从凝胶态到液晶态的转变,两者作用的结果,从而固系了脂蛋白的结构;②对酯酶有激活作用,HDL的磷脂在流动性增加时,ApoCⅠ通过HDL脂层表面后促进了LCAT的催化作用;③ApoCⅡ可以激活LPL,其激活机制可能是:LPL通常与外周循环肝素样分子结合并附着于血管内皮上,当LPL接触CM或VLDL时,LPL便同脂蛋白颗粒表面的磷脂发生作用,进而结合于脂蛋白颗粒上,其内的ApoCⅡ与LPL发生作用,改变LPL的空间结构,进而催化水解甘油三酯。 Apoc主要由肝合成,小肠也合成少量。 (四)ApoE ApoE是一种富含精氨酸的碱性蛋白,人AppE由299个氨基酸残基组成,分子量为34.145ku,含32个Arg和12个Lys,存在于血浆CM、VLDL及其残粒中,β-VLDL中含ApoE量高于VLDL,一部分ApoE在血液中与ApoAⅡ形成复合体。已测出ApoE的蛋白质一级结构,建立ApoE和cDNA序列,并确认ApoE有3个等位基因异构体以及基因在染色体上的定位。据推算和测定,在溶液中ApoE有62%的α-螺旋、9%的β-片层、11%的β-转角和18%的无规则线团。ApoE分子可以被凝血酶水解为N-端和C-端两个区域,N-端区(1-191)为22ku的可溶性球蛋白,此区域较稳定;C-端区(216-299)分子量为10ku,螺旋程度很高,不稳定,是与脂蛋白的结合区,ApoE主要由肝脏合成,近年来发现脑、肾、骨骼、肾上腺及巨噬细胞也能合成ApoE。 ApoE生理功能有:①是LDL受体的配体,也是肝细胞CM残粒受体的配体,它与脂蛋白代谢密切相关;②ApoE具有多态性,多态性与个体血脂水平及动脉粥样硬化发生发展密切相关。 (五)Apo(a) 早期测定脂蛋白(a)[LP(a)]在人群分布率为30%。目前采用更灵敏的方法发现几乎存在于所有人群中,仅是血浆深度差异很大,波动在0-1000mg/L的范围。1987年克隆了人Apo(a)的基因序列,并推导出氨基酸序列,提示Apo(a)的分子结构与纤溶酶原极为相似。Apo(a)含有一个疏水信号序列,37个Kringle-4拷贝、1个Kringle-5及1个胰蛋白酶样区。第36个Kringle-4含有一个额外未配对半胱氨酸,推测此处可能是Apo(a)以二硫键与ApoB结合的部位。经胰蛋白酶限制性水解Apo(a)发现,Apo(a)中的Krtingle-4有75%-85%的氨基酸与纤溶酶原的第391-472个氨基相同,有共同的抗原簇,两者表现有交叉反应。纤溶酶原(PG)是一种丝氨酸蛋白酶原,含有791个氨酸残基,结构中含有5个富含半胱氨酸的“Kringle”样结构,即Kringle1-5,在Kringle-5的后面为一丝氨酸蛋白酶区。PG与Apo(a)结构相似,如图4-3所示。
图4-3 载脂蛋白(a)结构示意图 A:KringleB:纤维蛋白溶酶原C:Apo(a) Kringle结构是三对二硫键组成的三套环形结构,含有78-82个氨基酸残基,因其序列的书写形式酷似一种丹麦面糕而得名。在其第1与第6、第2与第4、第3与第5半胱氨酸上,连成三个二硫键。这种结构也出现在前凝血酶、尿激酶、链激酶和纤溶酶原激活剂(t-PA)的组份中。由于Apo(a)分子中的Kringle-4数目可在15-27之间变化,从而导致Apo(a)有多种不同的异构体。 Apo(a)结构中有一蛋白酶区,推测其功能可能是一种酶。在分子中相当于PG蛋白酶的丝氨酸被精氨酸代替,可使其丧失酶的功能。由于Kringle结构与PG相似,推测Apo(a)可能结合到象PG受体或纤维蛋白那样的大分子上,再加上LP(a)颗粒携带的胆固醇结合到血管损伤部位,因此它不仅促进动脉粥样硬化形成,也阻碍血管内凝血块的溶解。
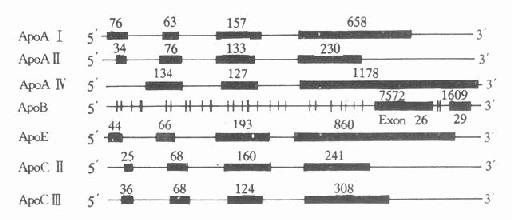
二、载脂蛋白的基因结构及表型(一)基因多态性概念 各种生物都能通过生殖产生子代,子代和亲代之间,不论在形态构造或生理功能的特点上都很相似,这种现象称为遗传(heredity)。但是,亲代和子代之间,子代的各个体之间不会完全相同,总会有所差异,这种现象叫变异(variation)。遗传和变异是生命的特征。遗传和变异的现象是多样而复杂的,正因为如此,才导致生物界的多种多样性,生物体所具有的遗传性状称为表型或表现型(phernotype)。生物体所具有的特异基因成分称为基因型(genotype)。表型是基因型与环境因素相互作用的结果。遗传物质是相对稳定的,但是又是可变的,遗传物质的变化以及由其所引起表型的改变,称为突变(mutation)。遗传物质突变包括染色体畸变和基因突变。基因突变是染色体中某一点上发生化学改变,所以又称为点突变(pointmutation)。基因结构和遗传表型的研究是深入了解脂蛋白代谢缺陷症的分子生物学基础,逆向遗传学方法(reversegeneticapproach)则使其有可能在蛋白质水平系统地分析结构和功能的关系。现已采用一个特定的cDNA探针从基因文库中筛选所需要的基因进行cDNA克隆,测定其核苷酸序列,然后从核苷酸序列推断蛋白质氨基酸序列。目前,已分离出许多与动脉粥样硬化有关的脂蛋白的cDNA克隆,并将其蛋白质一级结构的氨基酸排列顺序和基因的核苷酸顺序测出。现已查明,ApoAⅠ、AⅣ、E、B、CⅡ和(a)都存在着异构体,也就是说存在着各种不同的表型或基因型,并可分别从蛋白质水平和核酸水平进行分型。现分别介绍几种主要载脂蛋白的基因结构。 (二)载脂蛋白基因结构特点 人血浆中载脂蛋白的结构及功能,经过近十年的深入研究,已了解得较为清楚。大部分载脂蛋白的基因和cDNA都已得到分离和确定,其核苷酸顺序也进行了测定。除ApoAⅣ,B、(a)外,它们的共同特点是含有三个内含子(intron)和四个外显子(exon),其内含子插入外显子的位置大致相同,基本上按照生理功能的不同,将其加以分隔。第一个内含子把5′-末端的非翻译区和翻译区分开;第二个内含子把信号肽编码(singnalpeptide)和功能蛋白编码区分开;第三个内含子则把原肽编码区和成熟肽编码区分开。这些基因的第一、二、三外显子的核苷酸数量也相差无几,第四个外显子核苷酸数量不同而导致各种载脂蛋白基因长度不同。从生物进化角度考虑,上述载脂蛋白基因结构相似性,提示可能来源于一个共同的祖先,即ApoCⅠ基因。ApoAⅣ与其他载脂蛋白基因结构不同,它只含有三个外显子。载脂蛋白基因结构的另一特点是几个基因相接很近,定位于同一染色体的一个位点上或附近,呈紧密连锁状态。如ApoAⅠ、CⅢ和AⅣ基因位于第11号染色体长臂2区,形成一个约15kb的基因簇。还有一个紧密连锁的基因簇是ApoE、CⅠ和CⅡ基因,同位于第19号染色体长臂3区,见图4-4。 ApoA-Ⅱ基因定位于第1号染色体长臂2区,ApoB基因定位于第2号染色体短臂2区,Apo(a)基因定位于第6号染色体长臂2区。 (三)载脂蛋白基因结构 1.ApoAⅠApoAⅠ基因长1863bp,含有三个内含子,第一个内含子位于5′端非翻译区;第二个内含子位于翻译区的AⅠ前肽区内;第三个内含子插入翻译成熟AⅠ第43氨基酸残基处。ApoAⅠ基因含有四个外显子,分布于ApoAⅠ基因的不同区域,ApoAⅠ基因与ApoCⅢ、AⅣ基因相连成簇,CⅢ基因居中,转录方向与AⅠ和AⅣ基因相反。位于AⅠ和CⅢ基因共同3′区的DNA序列,可能参与对AⅠ基因的转录调控。
图4-4 人载脂蛋白AⅠ、AⅡ、AⅣ、B100、 CⅡ、CⅢ和E基因结构示意图 粗线代表外显子,粗线之间的细线代表内含子,粗线上缘数字 代表该段核苷酸数目 2.ApoBApoB族位于2号染色体P23→Pter区,是由非翻译区、编码区、TAA终止密码子和一个3′端的非翻译区组成。ApoB100基因全长43kb,含29个外显子和28个内含子见图4-4,其中第26和第29两个外显子特别长,分别含有7552和1905bp,外显子2最短,仅39bp(从211-249)。内含子则以第27个为最短(107bp)。人群中至少有14种不同的3′端高变异等位基因区,75%的人群在此区是不均一的。 ApoB48和ApoB100除了在结构上有关外,ApoB48的形成机制目前尚无完全一致的看法,主要认为有合成ApoB48的基因存在。1987年被发现ApoB48是由ApoB100通过一种新的机制涉及到mRNA的编辑而产生的。在测定从人小肠基因库分离的ApoBcDNA的序列时发现,小肠ApoBcDNA的第6666个核苷酸为T,而从肝分离的ApoBcDNA克隆在此位置为C。将T替换C则6666处产生一终止编码(TAA),TAA替换CAA编码使ApoB100的2153位氨基酸应为Gln,预示血浆中存在的ApoB48应是相当于ApoB100的2153氨基末端为Gln。这一预测后来得到实验证实,并发现核苷酸上6666的替换C→T只发生在小肠的mRNA上,而不发生在小肠基因组(genomic)DNA上,因此这是转录以后的一种特殊形成的编辑小肠mRNA的结果. 3.ApoE人ApoE基因位于19号染色体长臂3区,含有四个外显子和三个内含子。 1975年首先观察到ApoE的多态性,利用等电聚焦电泳和SDS-PAGE可以确认ApoE的多态性。实验表明,ApoE有三种异构体(isoform)即E2、E3和E4。有的人只含有一种主要异构体即纯合子,有的人可含二种主要异构体为杂合子。由此可见,人群中可有六种不同的表现。根据ApoE表型提出ApoE基因模型认为,ApoE的合成是由位于一个基因位点上的三个等位基因所控制,即E2、E3和E4,每一个等位基因对应于一个主要异构体,产生三种纯合子(E2/2,E3/3,E4/4)和三种杂合子(E2/3,E2/4,E3/4)共六种常见表型,另外,还有极少见的异构体。一般认为,次要异构体是由主要异构体翻译后,经唾液酸糖化修饰后转变而来。ApoE3/3型又称野生型。ApoE的基因序列的112位和158位两种氨基酸残基即精氨酸(Arg)和半胱氨酸(Cys)的交换决定了异构体的种类。ApoE4在这两个位置上都是Arg;E2都是Cys;112和158位是Arg者为ApoE3异构体。自然人群中,基因频率(3)分布最高,ApoE3/3表型分布约70%,见图4-5。 4.ApoC族ApoCⅡ基因有3347bp,含有4个外显子和3个内含子。ApoCⅡ的羧基末端氨基酸序列是激活脂蛋白脂肪酶的活性功能区域。ApoCⅢ基因含有3133bp,有4个外显子和3个内含子。
图4-5 人ApoE三种主要异构体的氨基酸残基及基因密码的改变位置 5.Apo(a)运用cDNA探针进行染色体定位研究时发现,Apo(a)的基因位点在人第6号染色体长臂2区6-7带间,与血纤溶酶原(PLG)的基因位点有部分重叠。测定PLG基因跨距为525kb,由18个内含子与19个外显子组成,5个Kringle结构由各自两个外显子编码。Apo(a)cDNA分析表明,Apo(a)与PLG的基因有很多相似之处。 通过家系研究,目前已发现Apo(a)基因位点中至少有26个等位基因与多态性有关。这些等位基因至少表达有34种Apo(a)异构体。
…… 第二节 高血糖症与糖尿病 第三节 低血糖症 第四节 糖代谢的先天性异常 第四章 血浆蛋白及其代谢紊乱 第一节 血浆脂蛋白 第二节 载脂蛋白(当前页) 第三节 脂蛋白受体 第四节 脂代谢有关酶类与特殊蛋白质 第五节 脂蛋白代谢 第六节 脂蛋白代谢紊乱 …… |