|
《人体寄生虫学》 > 第十一章 鞭毛虫
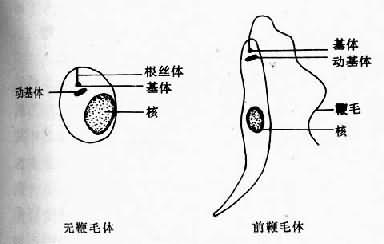
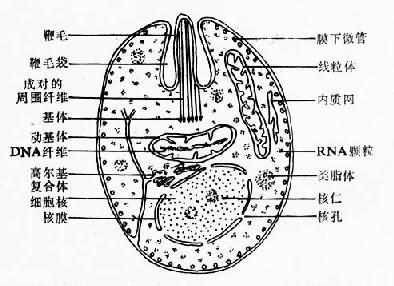
第一节 杜氏利什曼原虫利什曼原虫(Leishmania spp.)的生活史有前鞭毛体(promastigote)和无鞭毛体(amastigote)两个时期。前者寄生于节肢动物(白蛉)的消化道内,后者寄生于哺乳动物或爬行动物的细胞内,通过白蛉传播。对人和哺乳动物致病的利什曼原虫有:引起人体内脏利什曼病的为杜氏利什曼原虫[Leishmania donovani(Laveran et Mesnil,1903)],引起皮肤利什曼病的为热带利什曼原虫[L.tropica(Wright,1903)Lühe,1906]和墨西哥利什曼原虫[L.mexicana(Biagi,1953)Garnham,1962],引起粘膜皮肤利什曼病的为巴西利什曼原虫(L.araziliensis Vianna,1911)等。我国的黑热病是由杜氏利什曼原虫引起的。 杜氏利什曼原虫的无鞭毛体主要寄生在肝、脾、骨髓、淋巴结等器官的巨噬细胞内,常引起全身症状,如发热、肝脾肿大、贫血、鼻衄等。在印度,患者皮肤上常有暗的色素沉着,并有发热,故又称Kala-azar,即黑热的意思。因其致病力较强很少能够自愈,如不治疗常因并发病而死亡。 形态 寄生于人和其它哺乳动物单核吞噬细胞内的无鞭毛体又称利什曼型(Leishmania form)或利杜体(Leishman-Donovan body),虫体很小,卵圆形虫体大小为2.9~5.7×1.8~4.0µm;圆形虫体直径为2.4~5.2µm,常见于巨噬细胞内。经瑞氏染液染色后原虫细胞质呈淡蓝色或深蓝色,内有一个较大的圆形核,呈红色或淡紫色。动基体(kinetoplast)位于核旁,着色较深,细小,杆状(图11-1)。在1000倍的镜下有时可见虫体从前端颗粒状的基体(basal body)发现一条根丝体(rhizoplast)。基体靠近动基体,在光镜下不易区分开。 在透射电镜下,虫体由内外两层表膜包被。每一层为一个单位膜。在内层表膜下有排列整齐的管状纤维,称为膜下微管(subpellicular microtubule)微管数目、直径、间距等在种、株鉴定上有一定意义。虫体前端的表膜向内凹陷,形成一袋状腔,称为鞭毛袋。内有一根很短的鞭毛(即光镜下的根丝体)。基体为中空圆形。动基体为腊肠状,其内有一束与长轴平行的纤丝,该纤丝由DNA组成。由于动基体在虫体发育过程中可分出新的线粒体,因此,实际上它是一个大线粒体。其它线粒体呈泡状或管状,内有少数排列不整齐的板状嵴。类脂体圆形或卵圆形。内质网不发达,呈管状或泡状。核一个,卵圆形,大小约1.5×1.0µm。核膜两层可见核孔。核仁1~2个(图11-2)。
图11-1 杜氏利什曼原虫 前鞭毛体(promastigote)寄生于白蛉消化道。成熟的虫体呈梭形,大小为14.3~20µm×1.5.~1.8µm,核位于虫体中部,动基体在前部。基体在动基体之前,由此发现一鞭毛游离于虫体外(图11-1)。前鞭毛体运动活泼,鞭毛不停地摆动。在培养基内常以虫体前端聚集成团,排列成菊花状。有时也可见到粗短形前鞭毛体,这与发育程度不同有关。
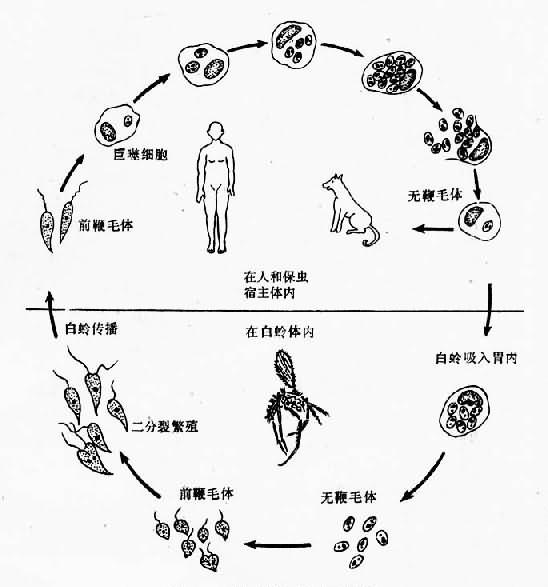
图11-2 杜氏利什曼原虫无鞭体超微结构模式图 生活史 杜氏利什曼原虫的生活史发育过程中需要两个宿主即白岭和人或哺乳动物。 1.在白蛉体内发育 当雌性白蛉(传播媒介)叮刺病人或被感染的动物时,血液或皮肤内含无鞭毛体的巨噬细胞被吸入胃内,经24小时,无鞭毛体发育为早期前鞭毛体。此时虫体呈卵圆形,鞭毛也已开始伸出体外。48小时后发育为短粗的前鞭毛体或梭形前鞭毛体。体形从卵圆形逐渐变为宽梭形或长度超过宽度3倍的梭形,此时鞭毛也由短变长。至第3、4天出现大量成熟前鞭毛体,长11.3~15.9µm(有时可达20µm),活动力明显加强,并以纵二分裂法繁殖,分裂时,基体、动基体及核首先分裂,然后虫体自前向后逐渐一分为二个子体。原来的鞭毛留在一个基体上,另一个基体重新生出一根鞭毛(图11-3)。在数量急增的同时,逐渐向白蛉前胃、食道和咽部移动。一周后具感染力的前鞭毛体大量聚集在口腔及喙。当白蛉叮刺健康人时,前鞭毛体即随白蛉唾液进入人体。 2.在人体内发育 感染有前鞭毛体的雌性白蛉叮吸人体或哺乳动物时,前鞭毛体即可随白蛉分泌的唾液进入其体内。一部分前鞭毛体被多形核白细胞吞噬消灭,一部分则进入巨噬细胞。前鞭毛体进入巨噬细胞后逐渐变圆,失去其鞭毛的体外部分,向无鞭毛体期转化。同时巨噬细胞内形成纳虫空泡(parasitophorous vacuole)。此时巨噬细胞的溶酶体与之融合,使虫体处于溶酶体的包围之中。无鞭毛体在巨噬细胞的纳虫空泡内不但可以存活,而且进行分裂繁殖,最终导致巨噬细胞破裂。游离的无鞭毛体又进入其它巨噬细胞,重复上述增殖过程(图11-3)。
图11-3 杜氏利什曼原虫生活史 利什曼原虫侵入巨噬细胞的机制 近年来体外试验研究结果表明,利什曼原虫首先粘附于巨噬细胞。再进入该细胞内。粘附的途径大体可分为两种:一种为配体-受体途径,一种为前鞭毛体吸附的抗体和补体与巨噬细胞表面的Fc或C3b受体结合途径。在调整(modulation)或封闭这些受体后可大大减少前鞭毛体与巨噬细胞的结合。还有试验表明,原虫质膜中的分子量63KD糖蛋白(GP63)能与巨噬细胞表面结合,发挥吸附作用。粘附后原虫随巨噬细胞的吞噬活动而进入细胞,而非前鞭毛体主动入侵巨噬细胞。 前鞭毛体转化为无鞭毛体的机制及两者的差异 利什曼原虫前鞭毛体转化为无鞭毛体的机制目前尚未完全阐明。一般认为可能与微小环境的改变如pH、温度等以及原虫所需营养物质和宿主对原虫产生的特异性等因素有关。实验证明,前鞭毛体以27℃为宜,无鞭毛体则需要35℃环境。它们的抗原性也有明显差异,各有不同的期特异抗原区带(Chang等,1982)。此外,微管蛋白(tubulin)也有较大差异。而生化方面的差异主要表现在量的不同。 机体对利什曼原虫的杀伤 利什曼原虫在巨噬细胞内寄生和繁殖,其抗原可在巨噬细胞表面表达。宿主对利什曼原虫的免疫应答属细胞免疫,效应细胞为激活的巨噬细胞。通过细胞内产生的活性氧杀伤无鞭毛体。含有无鞭毛体的巨噬细胞坏死可清除虫体。近年来有研究表明,抗体在宿主杀伤利什曼原虫的过程中也起了作用。 致病 人体感染杜氏利什曼原虫后,经3~5个月或更长的潜伏期,即可出现症状及体征。无鞭毛体在巨噬细胞内繁殖,使巨噬细胞大量破坏和增生。巨噬细胞增生主要见于脾、肝、淋巴结、骨髓等器官。浆细胞也大量增生。细胞增生是脾、肝、淋巴结肿大的基本原因,其中脾肿大最为常见,出现率在95%以上。后期则因网状纤维结缔组织增生而变硬。患者血浆内清蛋白量减少球蛋白量增加,出现清蛋白、球蛋白比例倒置。球蛋白中IgG滴度升高。血液中红细胞、白细胞及血小板都减少,这是由于脾功能亢进,血细胞在脾内遭到大量破坏所致。此外,免疫溶血也是产生贫血的重要原因。已有实验表明:患者的红细胞表面附有利什曼原虫抗原;杜氏利什曼原虫的代谢产物中有1~2种抗原与人红细胞抗原相同。因而,机体产生的抗利什曼原虫抗体有可能直接与红细胞膜结合,在补体参与下破坏红细胞。 由于血小板减少,患者常发生鼻衄、牙龈出血等症状。蛋白尿及血尿的出现,可能由于患者发生肾小球淀粉样变性以及肾小球内有免疫复合物的沉积所致。 患黑热病时出现免疫缺陷,易并发各种感染疾病,是造成黑热病患者死亡的主要原因。患者治愈后这种易并发感染的现象消失。可见杜氏利什曼原虫感染不但伴随有特异性细胞免疫反应的抑制,还可能导致机体对除了该原虫以外的其它抗原产生细胞免疫和体液免疫反应的能力降低,即非特异性抑制。例如患者对伤寒甲、乙菌苗的免疫应答显著下降。免疫力低下的原因,可能与原虫繁殖快速,产生的抗原过多,机体处于免疫无反应(anergy)状态有关。 患者经特效药物治疗后,痊愈率较高,一般不会再次感染,可获得终生免疫。 在我国黑热病有下列特殊临床表现: 皮肤型黑热病:大多分布于平原地区。据资料统计(王兆俊,1983)皮肤损害与内脏同时并发者,占58.0%;一部分病人(32.3%)发生在内脏病消失多年之后;还有少数(9.7%)既无内脏感染,又无黑热病病史的原发病人。皮肤损伤除少数为褪色型外,多数为结节型。结节呈大小不等的肉芽肿,或呈暗色丘疹状,常见于面部及颈部,在结节内可查到无鞭毛体。皮肤型黑热病易与瘤型麻风诊断混淆。此型黑热病更常见于印度、苏丹。 淋巴结型黑热病:此型患者的特征是无黑热病病史,局部淋巴结肿大,大小不一,位较表浅,无压痛,无红肿,嗜酸性粒细胞增多。淋巴结活检可在类上皮细胞内查见无鞭毛体。 实验诊断 1.病原检查 常用的方法有: ⑴穿刺检查: 1)涂片法:以骨髓穿刺物作涂片、染色,镜检。此法最为常用,原虫检出率为80%~90%。淋巴结穿刺应选取表浅、肿大者,检出率为46%~87%。也可做淋巴结活检。脾穿刺检出率较高,可达90.6%~99.3%,但不安全,少用。 2)培养法:将上述穿刺物接种于NNN培养基,置22~25℃温箱内。经一周,若培养物中查见活动活泼的前鞭毛体,则判为阳性结果。操作及培养过程应严格注意无菌。 3)动物接种法:穿刺物接种于易感动物(如地鼠、BALB/c小鼠等),1~2个月后取肝、脾作印片或涂片,瑞氏染液染色,镜检。 ⑵皮肤活组织检查:在皮肤结节处用消毒针头刺破皮肤,取少许组织液,或用手术刀乱取少许组织作涂片,染色,镜检。 2.免疫诊断法 ⑴检测血清抗体:如酶联免疫吸附试验(ELISA)、间接血凝试验(IHA)、对流免疫电泳(CIE)、间接荧光试验(IF)、直接凝集试验等,阳性率高,假阳性率也较高。近年来,用分子生物学方法获得纯抗原,降低了假阳性率。 ⑵检测血清循环抗原:单克隆抗体抗原斑点试验(McAb-AST)用于诊断黑热病,阳性率高,敏感性、特异性、重复性均较好,仅需微量血清即可,还可用于疗效评价。 3.分子生物学方法 近年来,用聚合酶链反应(PCR)及DNA探针技术检测黑热病取得较好的效果,敏感性、特异性高,但操作较复杂,目前未能普遍推广。 流行 杜氏利什曼原虫病属人兽共患疾病。除在人与人之间传播外,也可在动物与人,动物与动物之间传播。本病分布很广,亚、欧、非、拉美等洲均有本病流行。主要流行于中国、印度及地中海沿岸国家。在我国,黑热病流行于长江以北的广大农村中,包括山东、河北、河南、江苏、安徽、陕西、甘肃、新疆、宁夏、青海、四川、山西、湖北、辽宁、内蒙古及北京市郊等16个省市自治区。近年来主要在甘肃、四川、陕西、山西、新疆和内蒙古等地每年有病例发生,病人集中于陇南和川北。 根据传染来源的不同,黑热病在流行病学上可大致分为三种不同的类型,即人源型、犬源型和自然疫源型;分别以印度、地中海盆地和中亚细亚荒漠内的黑热病为典型代表。我国由于幅员辽阔,黑热病的流行范围又广,包括平原、山丘和荒漠等三种不同类型的地区,因此这三种不同类型的黑热病在国内都能见到。它们在流行历史,寄生虫与宿主的关系以及免疫等方面,有着明显的差别,在流行病学上也各有其特点,现归纳如下: ⑴人源型:多见于平原,分布在黄淮地区的苏北、皖北、鲁南、豫东以及冀南、鄂北、陕西关中和新疆南部的喀什等地,主要是人的疾病,可发生皮肤型黑热病,犬类很少感染,病人为主要传染源,常出现大的流行。患者以年龄较大的儿童和青壮年占多数,婴儿极少感染,成人得病的比较多见。传播媒介为空栖型中华白蛉和新疆的长管白蛉。 ⑵犬源型:多见于西北、华北和东北的丘陵山区,分布在甘肃、青海、宁夏、川北、陕北、冀东北、辽宁和北京市郊各县,主要是犬的疾病,人的感染大都来自病犬(储存宿主),病人散在,一般不会形成大的流行。患者多数是10岁以下的儿童。婴儿发病较高;成人很少感染。传播媒介为近野栖或野栖型中华白蛉。 ⑶自然疫源型:分布在新疆和内蒙古的某些荒漠地区,亦称荒漠型。主要是某些野生动物的疾病,在荒漠附近的居民点以及因开垦或从事其他活动而进入这些地区的人群中发生黑热病。患者几乎全是幼儿。来自外地的成人如获感染,可发生淋巴结型黑热病。传播媒介为野栖蛉种,主要是吴氏白蛉,亚历山大白蛉次之。 有些地区,还能见到由荒漠型发展到犬源型或从犬源型过渡到人源型的各种中间类型。在犬源型黑热病流行的西北等山丘地区,很可能有自然疫源的同时存在,犬的感染可不断地来自某些野生动物中的保虫宿主。 防治 我国在黑热病防治工作成绩卓著,由于在广大流行区采取查治病人,杀灭病犬和消灭白蛉的综合措施,到1958~1960年先后达到了基本消灭的要求。患病人数由1951年的53万人,至1990年降为360。但为了进一步巩固现有的防治成果,尽快在全国范围内达到控制及消灭黑热病之目的,尚应积极开展黑热病的防治工作。 治疗病人 注射低毒高效的葡萄糖酸锑纳,疗效可达97.4%。抗锑病人采用戊脘脒(pentamidine)、二脒替(stilbamidine)、羟眯替(hydroxystilbamidine isothionate)。经多种药物治疗无效而脾高度肿大且有脾功能亢进者,可考虑脾切除。 控制病犬 对病犬进行捕杀。但对丘陵山区犬类的管理确有一定困难,需寻找有效措施加以控制。 灭蛉、防蛉 在平原地区采用杀虫剂室内和畜舍滞留喷洒杀灭中华白蛉。在山区、丘陵及荒漠地区对野栖型或偏野栖型白蛉,采取防蛉、驱蛉措施,以减少或避免白蛉的叮刺(详见白蛉一节)。 至于自然疫源型流行区的疫源地分布和保虫宿主等问题仍有待查清,其防治对策也需研究。
…… 第十章 叶足虫 第一节 溶组织内阿米巴 第二节 其它消化道阿米巴 第三节 致病性自生生活阿米巴 第十一章 鞭毛虫 第一节 杜氏利什曼原虫(当前页) 第二节 锥虫 第三节 蓝氏贾第鞭毛虫 第四节 阴道毛滴虫 第五节 其它毛滴虫 …… |