|
《生理学》 > 第十一章 内分泌
第八节 松果体其他
一、松果体松果体细胞是由神经细胞演变而来的,它分泌的激素主要有褪黑素和肽类激素。来自颈上交感神经节后神经末梢与松果体细胞形成突触联系,通过释放去甲上腺素控制松果体细胞的活动。 (一)褪黑素1959年Lerner从牛松果体提取物中分离出一种能使青蛙皮肤褪色的物质,并命名为褪色素(melatonin),其化学结构为5-甲氧基-N-乙酰色胺。在松果体内羟化酶、脱羟酶、乙酰移位酶及甲基移位酶的作用下,色氨酸转变为褪色素。 松果体褪色素的分泌出现在明显的昼夜节律变化,白天分泌减少,而黑夜分泌增加。实验证明,大鼠在持续光照下,松果体重量变轻,细胞变小,合成褪色素的酶系活性明显降低,因而褪色素合成减少。反之,致盲大鼠或大鼠持续在黑暗环境中,将使松果体合成褪色素的酶系活发生增强,褪色素的合成随之增加。摘除动物的眼球或切断支配松果体的交感神经,则褪色素分泌的昼夜节律不再出现,说明光-暗对松果体活动的影响与视觉和交感神经有关。刺激交感神经可使松果体活动增强,而β-肾上腺素能受体阻断剂可阻断交感神经对松果体的刺激作用。如毁损视交叉上核,褪色素的昼夜节律性分泌消失。所以视交叉上核被认为是控制褪色素分泌的昼夜节律中枢,在黑暗条件下,视交叉上核即发出冲动传到颈上交感神经节,其节后纤维末梢释放去甲肾上腺素,与松果体细胞膜上的β-肾上腺素能受体结合,激活腺苷酸环化酶,通过cAMP-PK系统,增强褪色素合成酶系的活性,从而导致褪色素合成增加,在光刺激下,视网膜的传入冲动可抑制交感神经的活动,使褪色素合成减少。 褪色素对下丘脑-垂体-性腺轴与下丘脑-垂体-甲状腺活动均有抑制作用。切除幼年动物的松果体,出现性早熟,性腺与甲状腺的重量增加,功能活动增强。远在一个世纪之前,人们就发出某些性早熟男孩是因松果体肿瘤所致,因此认为松果体在青春期有抗性腺功能作用。正常妇女血中褪色素在有经周期的排卵前夕最低,随后在黄体期逐渐升高,月经来潮时达到顶峰,提示妇女朋经周期的节律与松果体的节律关系密切。 (二)肽类激素松果体能合成GnRH、TRH及8精-(氨酸)催产素等肽类激素。在多种哺乳动物(鼠、牛、羊、猪等)的松果体内GnRH比同种动物下丘脑所含的GnRH量高4-10倍。有人认为,松果体是GnRH和TRH的补充来源。
二、胸腺胸腺能分泌多种肽类物质,如胸腺素(thymosin)、胸腺生长素(thymopoietin)等,它们促进T细胞分化成熟。
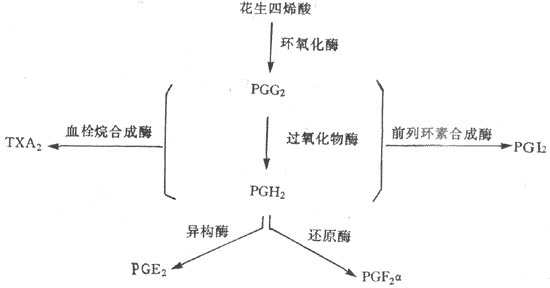
三、前列腺素前列腺素(prostaglandin,PG)是广泛存在于动物和人体内的一组重要的组织激素。PG的化学结构一般是具有五元环和两条侧链的二十碳不饱和脂肪酸。根据其分子结构的不同,可把PG分为A、B、D、E、F、H、I等型。 细胞膜的磷脂化在磷脂酶A2的作用下,生成PG的前体枣花生四烯酸。花生四烯酸在环氧化酶的催化下,形成不稳定的环内过氧化物枣PGG2,随后又转变为PGH2。PGH2在异构酶或还原酶的作用下,分别形成PGE2或PGF2α。PGG2与PGH2又可前列素合成酶的作用下,转变为前列环素(PGI2),在血栓烷合成酶的作用下变成血栓烷A2(TXA2)(图11-23)
图11-23 体内主要前列腺素的合成途径 另外,花生四烯酸在脂氧化酶的作用下,形成5-氢过氧酸,进而被代谢生成白三烯。 PG在体内代谢极快,除PGI2外,经过肺和肝被迅速降解灭活,在血浆中的半衰期公为1-2min。一般认为,PG不属于循环激素,而是在组织局部产生和释放,并对局部功能进行调节的组织激素。 PG的生物学作用极为广泛而复杂,几乎对机体各个系统的功能活动均有影响。例如,由血小板产生的TXA2,能使血小板聚集,还有能使血管收缩的作用。相反,由血管内膜产生PHG2,能抑制血小板聚集,并有舒张血管的作用。PGE2有明显的抑制胃酸分泌的作用,它可能是胃液分泌的负反馈抑制物,PGE2可增加肾血流量,促进排钠利尿。此外,PG对体温调节、神经系统、以及内分泌与生殖均有影响。 参考资料 1.程治平主编 内分泌生理学 北京:人民卫生出版社,1984 2.邓洁英 生长介素 中华内分泌代谢杂志 1988;4:167-171 3.杨义力 糖皮质激素受体的结构和功能生理科学进展1989;20:133-136 4.谭景莹 甾体激素对基因表达的调节作用,生理科学进展1989;20:223-237 5.蔡子微,李健群 甲状腺激素对细胞核RNA合成的影响生理科学进展 1989;20:363-365 6.马青年 近年内分泌学基础研究值得注意的几个方面生理通讯 1992;11:3棗5 7.朱岩,邱学才 糖皮质激素“允许作用”的可能机制生理科学进展1993;24:263棗226 8.Fukayma s etal.Human parthyroid hirmone(PTH)-related protein and human PTH:comparativebiological activities on human bone cells and bone resorption.Endocrinology1988;123:2841_2848 9.Samuels HH et al.Regulation ofgene expression by thyroid hormone.Ann Rev Physiol 1989;51:623_639 10.Burnstein KL,CidlowskiJA,Regulation of gene expression by glucocorticoids.Ann Rev Physiol1989;51:683_639 11.Winer LM et al. Basal plasmagrowth hormone levels in man: new evidence for rhythmicity of growth hormonesecretion. J Clin Endocrinol Metab 1990;70:1678-11686 12.Emiliano C et al.Human growthhormone and human aging.Endocrinol Rev 1993;14:20-39
|