|
《医用化学》 > 第十七章 取代羧酸和对映异构
第三节 对映异构同分异构现象在有机化合物中十分普遍,它包括构造异构和立体异构两大类: 对映异构是立体异构中的一类,表现在各个对映异构体对平面偏振光的作用不同。
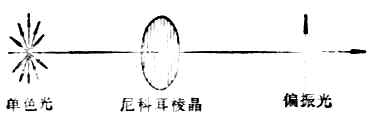
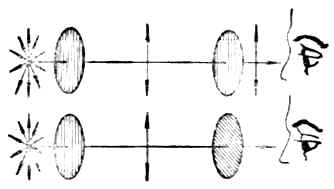
一、平面偏振光和物质的旋旋光性(一)偏振光和偏振光的振动面 光波是电磁波,是横波。其特点之一是光的振动方向垂直于其传播方向。普通光源所产生的光线是由多种波长的光波组成,它们都在垂直于其传播方向的各个不同的平面上振动。图17-1(左)表示普通的单色光束朝我们的眼睛直射过来时的横截面。光波的振动平面可以有无数,但都与其前进方向相垂直。
图17-1 平面偏振光的形成
图17-2 两个尼科耳棱晶平行放置(上)或重直放置(下)时的情况 当一束单色光通过尼科目棱晶(由方解石晶体加工制成,图17-1中)时,由于尼科耳棱晶只能使与其晶轴相平行的平面内振动的光线通过,因而通过尼科耳棱晶的光线,就只在一个平面上振动。这种光线叫做平面偏振光,简称偏振光(图17-1右)。偏振光的振动方向与其传播方向所构成的平面,叫做偏振光的振动面。 当普通光线通过尼科耳棱晶成为偏振光后,再使偏振光通过另一个尼科耳棱晶时,则在第二个尼科耳棱晶后面可以观察到:如果两个尼科耳棱晶平行放置(晶体相互平行)时,光线的亮度最大(图17-2上);如两个棱晶成其他角度时,则光线的亮度发生不同程度的减弱,接近90°时较暗,接近0°时较明亮。 (二)旋光性物质和物质的旋光性 自然界中有许多物质对偏振光的振动面不发生影响,例如水、乙醇、丙酮、甘油及氯化钠等;还有另外一些物质却能使偏振光的振动面发生偏转,如某种乳酸及葡萄糖的溶液。能使偏振光的振动面发生偏转的物质具旋光性,叫做旋光性物质;不能使偏振光的振动面发生偏转的物质叫做非旋光性物质,它们没有旋光性。 当偏振光通过旋光性物质的溶液时,可以观察到有些物质能使偏振光的振动面向左旋转(逆时针方向)一定的角度(图17-3),这种物质叫做左旋体,具有左旋性,以“-”表示;另一些物质则使偏振光的振动面向右旋转(顺时针方向)一定的角度,叫做右旋体,它们具有右旋性,以“+”表示。以前也曾用“l、d”表示左右旋。
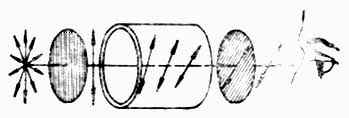
图17-3 左旋体使偏振光的振动面向左旋转 (三)旋光度和比旋光度 如将两个尼科耳棱晶平行放置,并在两个棱晶之间放一种溶液(图17-4),在第一个棱晶(起偏振器)前放置单色可见光源,并在第二个棱晶(检偏振器)后进行观察。可以发现,如在管中放置水、乙醇或丙醇时,并不影响光的亮度。但如果把葡萄糖或某种乳酸的溶液放于管内,则光的亮度就减弱以至变暗。这是由于水、乙醇等是非旋光性物质,不影响偏振光的振动面;而葡萄糖等是旋光性物质,它们能使偏振光的振动面向右或左偏转一定的角度。要达到最大的亮度,必须把检测振器向右或向左转动同一角度。旋光性物质的溶液使偏振光的振动面旋转的角度,叫做旋光度,以α表示。
图17-4 旋光性测定示意图 一种物质的旋光性,主要决定于该物质的分子结构。但在测定物质的旋光度时,还受到测定条件的明显的影响。影响旋光度的因素包括溶液浓度、液层厚度(即盛液管的长度)、所用光线(单色光)的波长、温度以及溶剂等。因此,同一种旋光性物质在不同条件下测定α值时,所得的结果也不一样。但如固定实验条件,则测得的物质的旋光度即为常数,它能反映该旋光性物质的本性,叫做比旋光度,以[α]表示。比旋光度与测得的旋光度(α)有以下的关系:
式中:λ——测定时所用单色光的波长,通常用钠光的D线(λ=589nm) c——溶液浓度(g·ml-1) l——盛液管的长度(dm) 当c和l都等于1时,则[α]= α。因此,物质的比旋光度就是浓度为1g·ml-1的溶液,放在1dm长的管中测得的旋光度。所用溶剂须写在比旋光度值后面的括号中。因为即使在其他条件都相同时,改变溶剂也会使[α]值发生变化。 比旋光度是旋光性物质的一种物理常数。如像每种物质都有一定的熔点、沸点、折射率、密度一样,各种旋光性物质都有其比旋光度。
二、化合物的旋旋光性与结构的关系(一)三种乳酸 自然界中有许多种旋旋光性物质。例如,人体中肌肉运动时可产生乳酸, 其[α]20D为+3.82°(水);由左旋乳酸杆菌使乳酸发酵得另一种乳酸,[α]20D是-3.82°(水)。这两种乳酸的构造式都是 旋光性不同(旋光方向相反,比旋亮度的绝对值相同)外,其他物理、化学性质都一样(表17-1)。这两种乳酸的分子结构可用球棒模型表示(图17-5)。 表17-1三种乳酸性质的比较
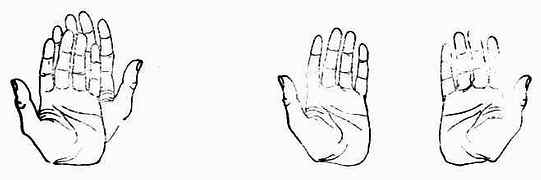
图17-5 (+)-乳酸及(-)-乳酸的球棒模型 从模型可以看出,左旋乳酸与右旋乳酸的分子结构的关系有如物体与其镜象的关系,但二者不能重合,好比人的左手与右手、左脚与右脚一样。(+)-乳酸与(-)-乳酸的构造式相同而构型不同,所以属于立体异构中的构型异构。这两个构型异构体互呈物体与其镜象关系,能对映而不能重合,故把它们叫做对映体。这种立体异构属于对映异构。 一个物质可能有两个、三个或多个具有旋光性的异构体。如果某物质只有两个具有旋光性的异构体,它们一定是对映体。如果某物质有不止两个具有旋光性的异构体,则各异构体之间并不都是对映体的关系,这将在后讨论。 除了上述的(+)-用(-)-乳酸外,人工合成法所得的乳酸没有旋光性,即[α]20D=0。这种乳酸叫做外消旋乳酸,用(±)-乳酸表示(表17-1)。(±)乳酸是由等物质的量的(+)-及(-)-乳酸组成的。 由此可见,乳酸有三种:(+)-、(-)-、及(±)-乳酸。 (二)、分子的手性和手性分子 如将一个物体放在平面镜前使之成像“取”出,则物体与其镜象是否相同,即能否重合呢?这自然只有两种可能,即可以重合或不能重合。如果是人的一只手,则与其镜象不能重合(图17-6)。因为左手的镜象是右手,它们相互是不可能重合的。物体与其镜象不能重合的例子很多,例如螺丝钉(图17-7)、人的耳朵等。
图17-6 左:左、右手不能重合 右:左手的镜象是右手
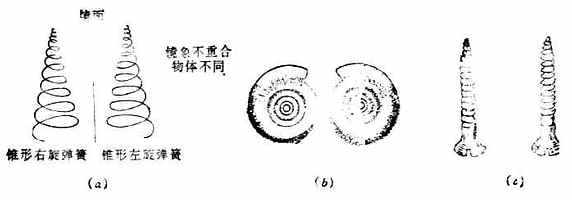
图17-7 物体与其镜象不能重合(α)右旋弹簧与左旋弹簧;(b)蜗牛壳;(c)左螺纹与右螺纹螺丝钉 上述情况在有机化合物中也存在。许多分子能与其镜象重合,例如甲烷、乙醇、乙醚、丙酮等。但也有许多分子与其镜象不能重合,例如(+)-乳酸及(-)-乳酸的分子结构之间的关系好比人的左手与右手的关系,因此把这种分子叫做手性分子,它们具有手性。凡是手性分子都有旋光性。如果一个分子与其镜象等同,即能重合,则叫做非手性分子,非手性分子没有旋光性。 一个物质的分子是否具有手性是由它的分子结构决定的。最常见的手性分子是含手性碳原子的分子。所谓手性碳原子是指连有四个不同的原子或原子团的碳原子,这种碳原子常以星号“*”标示。例如乳酸分子中有三个碳,但只有C-2才是手性碳原子,它连接的是-H,-OH,-CH3及-COOH这四个原子或原子团。手性碳原子也叫做不对称碳原子。
凡是含有手性碳原子的分子都有对映异构体,但是含手性碳原子的分子不一定是手性分子(见本节四)。
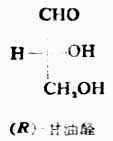
三、含一个手性碳原子的分子含一个手性碳原子的化合物有一对对映异构体。 (一)外消旋体 两个对映体的等物质的量混合物的比旋亮度为零。这种混合物叫做外消旋体。与各对映体相比较,外消旋体无旋旋光性外,其理化性质也不同,它的生理或药理作用与各对映体往往有明显的差异。 除了用特殊方法外,用通常化学合成的具手性碳原子的化合物,基本上是外消旋体。要想从外消旋体得到旋光纯的异构体,要采用特定的方法把左旋体与右旋体分开,这个过程叫做拆分。 (二)对映异构体的构型 1. 为了方便起见,对映异构体的构型通常采用费歇尔投影式来表示,即把手性碳原子所连的四个原子或原子团按规定的方法投影到纸上。这种方法包括:(1)手性碳原子写在纸平面上,或用一个“+”字形的交叉点代表这个手性碳,四端分别连四个不同的原子或原子团;(2)以垂直与手性碳相连的是伸向纸平面手后方的两个原子或原子团,以水平线与手性碳原相连的是伸向纸平面前方的两上原子或原子团;(3)通常把碳链放在垂直线上,并把命名时编号最小的碳原子放在上端。费歇尔投影式是以两维式来表示含手性碳原子的分子的三维结构。 2.相对构型与绝对构型 物质分子中各原子或原子团在空间的实际排布叫做这种分子的绝对构型。现在已能用X射线衍射等方法测定了许多化合物分子的绝对构型,但在1951年以前还没有解决这个问题。1906年,罗沙诺夫建议把(+)-及(-)-甘油醛作为其他旋光性异构体物质的构型的比较标准,并人为地规定,在费歇尔投影式中,手性碳上的OH排在横线右边的为右旋甘油醛(Ⅰ),作为D型,手性碳上的OH排在横线左边的为左旋甘油醛(Ⅱ),作为L型。D-及L-分别表示它们的构型。应注意,D及L仅表示其构型,与其旋光性(+)、(-)无关。当一个旋光性物质发生化学反应时,只要手性碳上的任何一个键都未断裂,则这个手性碳的构型就没有改变。这样,许多其他物质分子的构型都可以通过直接或间接的化学转变,与D型或L型甘油醛相联系,其条件是相当于甘油分子的手性碳上的每一个键,在转变过程中都不发生断裂。如果该物质与D型甘油醛相联系时,其分子的构型即为D型,如与L型甘油醛相关联时,它的分子构型则属于L型。用这种方法确定的构型是相对于标准物质——甘油醛而来的,所以叫做相对构型。
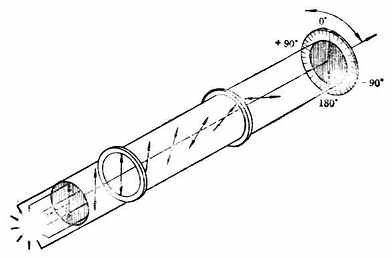
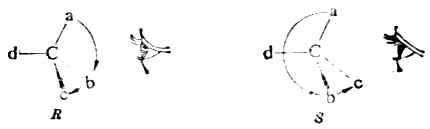
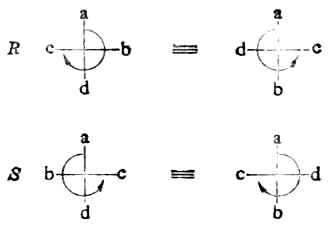
罗沙诺夫所作的上述规定为确定其他一些物质分子的构型带来方便,但这毕竟是人为规定的。直到1951年才有人证明D-(+)-甘油醛的真正构型与罗沙诺夫的规定是一致的。这样一来,无论是甘油醛还是与它们相关联的各旋光性物质的相对构型也都是绝对构型了。现在已有许多旋光性物质用不同的方法确定了绝对构型。关于D型和L型的概念目前在一些化合物如糖类及α氨基酸中仍然应用。 现在认为,构型与旋光性之间没有必然的联系。物质的旋光性仍须通过实验测定。 (三)、对映异构体的系统命名法 对映异构体的系统命名法即IUPAC命名法。这是根据物质分子的绝对构型或其费歇尔投影式来命名的,故无须与其他化合物联系比较。 含一个手性碳的分子C*abcd命名时,首先把手性碳所连的四个原子或原子团按照次序规定排列其优先顺序,如a>b>c>d其次,将此排列次序中排在最后的原子或原子团(即d)放在距观察者最远的地方。这时,其他三个原子或原子团就向着观察者(图17-8)。然后,再观察从最优先基a开始到b再到c的次序,如果是顺时针方向排列的(图17-8左),这个分子的构型即用“R”标示(R取自拉丁方Rectus,右);如果a→b→c是逆时针方向排列的(图17-8右),则此分子的构型用“S”标示(S取自拉丁方Sinister,左)。
图17-8 R及S构型 例1.
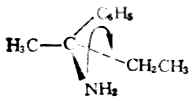
优先顺序 -CL>-OCH3>-CH3>-H 例2.
-NH2>C6H5>-C2H5>-CH8 用构型的费歇尔投影式,同样可以确定一个分子是R还是S构型。先要确定C*abcd中,a、b、c及d的优先顺序,如a>b>c>d。在费歇尔投影式中,如最小基d连在垂直方向,即C*-d键伸向纸平面的后方,则当a→b→c为顺时针方向时,此分子为R型;如a→b→c为逆时针方向时,则是S型。如最小基d连在水平方向,即C*-d键伸向纸平面的前方,则当a→b→c为顺时针方向时,此分子为S型;如a→b→c为逆时针方向时,为R型(图17-9)。
图17-9 用费歇尔投影式确定R/S构型 例1.
例2.
要把R/S构型与D/L构型分开,不能认为D型的分子即R型的,或L型的分子即S型的。例如:
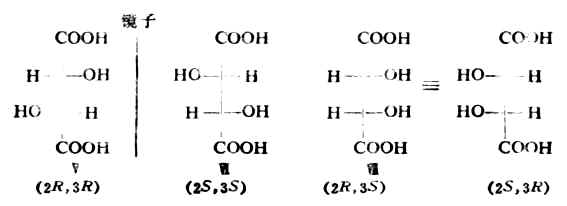
四、含两个手性碳原子的分子在有机化合物中,随着手性碳原子数目的增加,对映异构现象也愈杂。 (一)含两个不同的手性碳原子的分子 这类分子中,两个手性碳不同,即一个手性碳上所连的四个原子或原子团与另一个手性 碳上所连的不同或不完全相同。这种分子有四种具有旋旋光性的异构体,例如,2-羟基-3-氯丁二酸 是-H,-OH,--COOH及-CHCLCOOH,C-3上连的是-H,CL,-COOH及-CHOHCOOH,这是两个不同的手性碳。它们的费歇尔投影式如下:
Ⅰ与Ⅱ是一对对映体,Ⅲ与Ⅳ是另一对对映体。Ⅰ(或Ⅱ)与Ⅲ(或Ⅳ)虽是具有旋光性的异构体,但并不是对映体,而是非对映异构体(非对映体)。非对映体之间不仅旋光性不同,理化性质也有一定的差异(表17-2)。 表17-2 2-羟基-3-氯丁二酸的一些物理性质
任何含两个不同的手性碳原子的分子都有四个立体异构体,即两对对映体。 含两个或两个以上手性碳的分子中,每个手性碳的构型都须用R/S标示,写在化合物名称之前,并标以该手性碳的位次。例如,Ⅰ为(2S,3S)-2-羟基-3-氯丁二酸。 (二)含两个相同的手性碳原子的分子 这类分子中,两个手性碳相同。例如,酒石酸的 C-2与C-3都是手性碳,且各连有-H,-OH,-COOH及-CHOHCOOH,这是两个相同的手性碳原子。它们的费歇尔投影式如下:
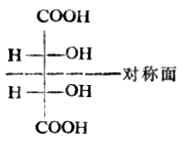
Ⅴ与Ⅵ是一对对映体。Ⅶ的两个费歇尔投影式是等同的。因为将任何一个在纸平面上旋转180°即得另一个。Ⅶ虽有两个手性碳原子,却不具旋光性。这是由于这个分子是对称的,它有一个对称面,即垂直于C(2)-C(3)键的平面。这种异构体叫做内消旋体,用meso-或i-表示。
内消旋酒石酸与外消旋酒石酸虽然都不具旋光性,但它们有本质上的不同。内消旋体是纯物质,不能拆分;外消旋体则能拆分为左旋体及右旋体。内消旋体的性质与左旋体或右旋体也有差异(表17-3)。 表17-3 几种酒石酸的性质
含n个不同的手性碳原子的分子有2n个立体异构体,成为2n-1对对映体。
五、光学活性物质在医学上的意义在生物体中存在的许多化合物都是手性的。例如,在生物体中普遍存在的α-氨基酸主要是L-型,从天然产物中得到的单糖多为D-型。生物体对某一物质的要求常严格地限定为某个单一的构型。所以与生物物质有关的合成物质,如果有旋旋光性的异构体,也往往只有其中之一具较强的生理效应,其对映体或是无活性或活性很小,有些甚至产生相反的生理作用。例如;作为血浆代用品的葡萄糖酐一定要用右旋糖酐,因为其左旋体会给病人带来较大的危害;右旋的维生素C具有抗坏血病作用,而其对映体无效。左旋肾上腺素的升高血压作用是右旋体的20倍;左旋氯霉素是抗生素,但右旋氯霉素几乎无抗生作用。 由于旋光性物质的左、右旋体还可能有不同类型的生理作用,所以在临床医学上有不同的应用。例如,右旋四咪唑为抗抑郁药,其左旋体则是治疗癌症的辅助药物;右旋苯丙胺是精神兴奋药,其左旋体则具抑制食欲作用。 临床医学还须考虑对映体之一的毒副作用。例如,(R)-(+)-反应停是镇静剂,用于各种麻疯反应,而其对映体(S)-(-)-反应停则有致畸作用。
…… 第一节 羧酸 第二节 羧酸衍生物 第十七章 取代羧酸和对映异构 第一节 羟基酸 第二节 氧代酸 第三节 对映异构(当前页) 第十八章 含氮有机化合物 第一节 胺类 第二节 酰胺 第三节 氨基酸 …… |

 ,它们的性质除旋
,它们的性质除旋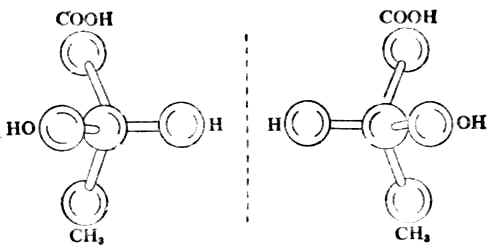




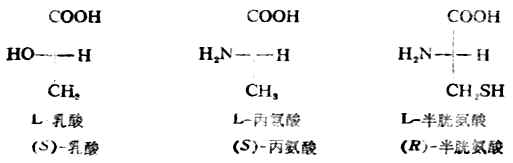
 。它的C-2上连的
。它的C-2上连的