|
《医用化学》 > 第一章 溶液
第三节 溶液的渗透压渗透作用是自然界的一种普遍现象,它对于人体保持正常的生理功能有着十分重要的意义。下面讨论渗透作用的基本原理、渗透压及其在医学上的意义。
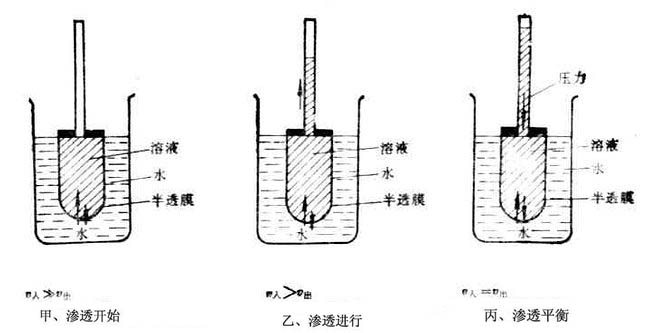
一、渗透现象和渗透压在蔗糖浓溶液上小心加入一层清水,水分子即从上层渗入下层,蔗糖分子也由下层涌入上层,直到蔗糖溶液的浓度均匀为止。一种物质的粒子自发地分布于另一种物质中的现象称为扩散。 如果将蔗糖水溶液与水用半透膜隔开(图1-2甲),使膜内和膜外液面相平,静置一段时间后,可以看到膜内溶液的液面不断上升(图1-2乙),说明水分子不断地透过半透膜进入溶液中。溶剂透过半透膜进入溶液的自发过程称为渗透现象。不同浓度的两种溶液被半透膜隔开时都有渗透现象发生。 半透膜是一种只允许某些物质透过,而不允许另一些物质透过的薄膜。上面实验中的半透膜只允许水分子透过,而蔗糖分子却不能透过。细胞膜、膀胱膜、毛细血管壁等生物膜都具有半透膜的性质。人工制造的火棉胶膜、玻璃纸等也具有半透膜的性质。 上述渗透现象产生的原因是蔗糖分子不能透过半透膜,而水分子却可以自由通过半透膜。由于膜两侧单位体积内水分子数目不等,水分子在单位时间内从纯水(或稀溶液)进入蔗糖溶液的数目,要比蔗糖溶液中水分子在同一时间内进入纯水(或稀溶液)的数目多,因而产生了渗透现象。渗透现象的产生必须具备两个条件:一是有半透膜存在,二是半透膜两侧必须是两种不同浓度的溶液。 图1-2是渗透过程的示意图,图中v入表示水分子进入半透膜内的速度,v出表示膜内水分子透出到膜外的速度。甲表示渗透刚开始,乙表示渗透不断进行,管内液面不断上升。但是液面的上升不是无止境的,而是达到某一高度时便不再上升(图1-2丙),此时,v入=v出,渗透达到平衡状态即渗透平衡。阻止纯溶剂向溶液中渗透,在溶液液面上所施加的压力为该溶液的渗透压。
如果被半透膜隔开的是两种不同浓度的溶液,这时液柱产生的静液压,既不是浓溶液的渗透压,也不是稀溶液的渗透压,而是这两种溶液渗透压之差。 渗透压的单位用Pa或kPa表示。 渗透压是溶液的一个重要性质,凡是溶液都有渗透压。渗透压的大小与溶液的浓度和温度有关。
二、渗透压与浓度、温度的关系1886年范特荷甫(van’t Hoff)根据实验数据得出一条规律:对稀溶液来说,渗透压与溶液的浓度和温度成正比,它的比例常数就是气体状态方程式中的常数R。这条规律称为范特荷甫定律。用方程式表示如下: πV=nRT 或π=cRT(1-5) 式中π为稀溶液的渗透压,V为溶液的体积,c为溶液的浓度,R为气体常数,n为溶质的物质的量,T为绝对温度。 式(1-5)称为范特荷甫公式,也叫渗透压公式。常数R的数值与π和V的单位有关,当π的单位为kPa,V的单位为升(L)时,R值为8.31kPa•L•K-1•mol-1。 范特荷甫公式表示,在一定温度下,溶液的渗透压与单位体积溶液中所含溶质的粒子数(分子数或离子数)成正比,而与溶质的本性无关。 对于稀溶液,c近似于质量摩尔浓度,因此上式又可写成 π=mBRT 对于相同cB的非电解质溶液,在一定温度下,因为单位体积溶液中所含溶质的粒子(分子)数目相等,所以渗透压是相同的。如0.3mol•L-1葡萄糖溶液与0.3mol•L-1蔗糖溶液的渗透压相同。但是,相同cB的电解质溶液和非电解质溶液的渗透压则不相同。例如,0.3mol.L-1NaCl溶液的渗透压约为0.3mol.L-1葡萄糖溶液渗透压的2倍。这是由于在NaCl溶液中,每个NaCl粒子可以离解成1个Na+和1个Cl-。而葡萄糖溶液是非电解质溶液,所以0.3mol•L-1NaCl溶液的渗透压约为0.3 mol•L-1葡萄糖溶液的2倍。 由此可见,渗透压公式中,对电解质溶液来说,浓度cB(或mB)是1升溶液中能产生渗透效应的溶质分子与离子总物质的量,称为渗透物质的量浓度。 通过测定溶液的渗透压,可以计算溶质的相对分子质量。如果溶质的质量为m,摩尔质量为M。实验测得溶液的渗透压为π,则该溶质的相对分子质量(数值等于摩尔质量)可通过下式求得:
式(1-6)主要用于测定高分子(蛋白质等)的相对分子质量。 渗透压公式在医疗工作中有其现实意义。人体血液的渗透压在正常体温(37℃)时约为769.9kPa。要配制与血液渗透压相等的溶液,即可由渗透压公式计算出溶液的浓度。
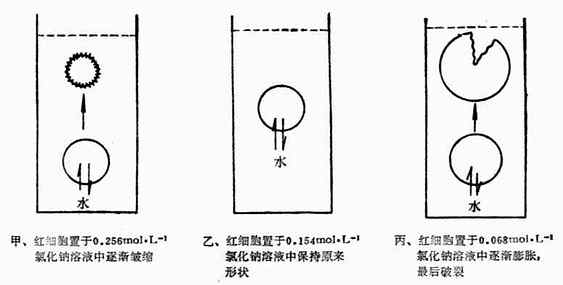
三、渗透压在医学上的意义(一)等渗、低渗、高渗溶液 渗透压相等的两种溶液称为等渗溶液。渗透压不同的两种溶液,把渗透压相对高的溶液叫做高渗溶液,把渗透压相对低的溶液叫做低渗溶液。对同一类型的溶质来说,浓溶液的渗透压比较大,稀溶液的渗透压比较小。因此,在发生渗透作用时,水会从低渗溶液(即稀溶液)进入高渗溶液(即浓溶液),直至两溶液的渗透压达到衡为止。 在医疗实践中,溶液的等渗、低渗或高渗是以血浆总渗透压为标准。即溶液的渗透压与血浆总渗透压相等的溶液为等渗溶液。溶液的渗透压低于血浆总渗透压的溶液为低渗溶液。溶液的渗透压高于血浆总渗透压的溶液为高渗溶液。 给伤病员进行大量补液时,常用与血浆等渗的0.154mol•L-1NaCl溶液(生理盐水),而不能用0.256 mol•L-1NaCl的高渗溶液或0.068 mol•L-1NaCl的低渗溶液。这是与血浆渗透压有关的问题。下面讨论红细胞分别在这三种NaCl溶液中所产生的现象。 将红细胞放到0.068 mol•L-1 NaCl溶液中,在显微镜下可以看到红细胞逐渐膨胀,最后破裂。医学上称这种现象为溶血。这是因为红细胞内液的渗透压大于0.068mol·L-1NaCL溶液渗透压,因此,水分子就要向红细胞内渗透,使红细胞膨胀,以致破裂.如将红细胞放到0.256mol·L-1NaCL溶液中,在显微镜下可以看到红细胞逐渐皱缩,这种现象称为胞浆分离.因为这时红细胞内液的渗透压小于0.256mol·L-1NaCL溶液的渗透压,因此,水分子由红细胞内向外渗透,使红细胞皱缩.如将红细胞放到生理盐水中,在显微镜下看到红细胞维持原状.这是因为红细胞与生理盐水渗透压相等,细胞内外达到渗透平衡的缘故.图1-3为细细胞在不同浓度NaCL溶液中的形态图。
图1-3 红细胞在不同浓度NaCl溶液中的形态未意图 在医疗工作中,不仅大量补液时要注意溶液的渗透压,就是小剂量注射时,也要考虑注射液的渗透压。但临床上也有用高渗溶液的,如渗透压比血浆高10倍的2.78mol·L-1葡萄糖溶液。因对急需增加血液中葡萄糖的患者,如用等渗溶液,注射液体积太大,所需注射时间太长,反而不易收效。需要注意,用高渗溶液作静脉注射时,用量不能太大,注射速度不可太快,否则易造成局部高渗引起红细胞皱缩。当高渗溶液缓缓注入体内时,可被大量体液稀释成等渗溶液。对于剂量较小浓度较稀的溶液,大多是将剂量较小的药物溶于水中,并添加氯化钠、葡萄糖等调制成等溶液,亦可直接将药物溶于生理盐水或0.278mol·L-1葡萄糖溶液中使用,以免引起红细胞破裂。 (二)毫渗透量浓度 人的体液中既有非电解质(如葡萄糖等),也有电解质(如NaCL,CaCL2,NaHCO3等盐类)。为了表示体液总的渗透压大小,医学上常用毫渗透量浓度来比较,简称毫渗量·升-1,用mOsm·L-1表示。这种浓度是溶液中能产生渗透作用的溶质的粒子(分子或离子)的总物质的量浓度。 例7分别计算0.278mol·L-1葡萄糖溶液和生理盐水(0.154mol·L-1NaCL)的毫渗透量浓度。 解:0.278mol·L-1葡萄糖溶液的毫渗透量浓度为:0.278×1000=278≈280(mOsm·L-1)生理盐水的毫渗透量浓度为:0.154×2×1000=308(mOsm·L-1) 由于在一定温度下,溶液的渗透压与溶液的毫渗量·升-1成正比,因此,常用它来衡量或比较溶液渗透压的大小.表1-4为正常人血浆中各种离子的毫渗量浓度. 从表4-1可看出,正常人血浆中各种离子的总浓度为151.0+139.5=290.5mOsm·L-1(血浆中非电解质如葡萄糖、尿素等含量较少,仅相当于5mOsm·L-1左右)。临床上规定血浆总渗量浓度正常范围是280~320mOsm·L-1。如果溶液的毫渗透量浓度处于这个范围以内,则为血浆的等渗溶液;小于此范围的溶液为低渗溶液;大于此范围的溶液则为高渗溶液。 表1-4 正常人血浆中各种离子的mOsm·L-1
由例7计算结果说明生理盐水为血浆的等渗溶液,0.278mol.L-1葡萄糖溶液为278mOsm·L-1近似于280mOsm·L-1,所以它也是血浆的等渗溶液. 临床上常用的等渗溶液有: 1. 生理盐水(0.154mol·L-1NaCL溶液),毫渗透量深度为308mOsm·L-1。 2.0.278mol·L-1葡萄糖溶液,亳渗量溶液浓度为278mOsm·L-1(近似于280mOsm·L-1)。 3.0.149mol·L-1碳酸氢钠溶液,毫渗透量浓度为298mOsm·L-1。 临床上常用的高渗溶液有: 1.0.513mol·L-1.NaCL溶液,毫渗透量浓度为1026mOsm·L-1. 2.0.278mol·L-1葡萄糖氯化钠溶液(是生理盐水中含0.278mol·L-1葡萄糖),毫渗透量浓度应为308+278=586mOsm·L-1,其中生理盐水维持渗透压,葡萄糖则供给热量和水. 3.2.78mol·L-1葡萄糖溶液,毫渗透量浓度为2780mOsm·L-1。 (三) 晶体渗透压和胶体渗透压 血浆中含有低分子的晶体物质(如氯化钠、葡萄糖和碳酸氢钠等)和高分子的胶体物质(如蛋白质)。血浆中的渗透压是这两类物质所产生渗透压的总和。其中由低分子晶体物质产生的渗透压叫做晶体渗透压;由高分子胶体物质产生的渗透压叫做胶体渗透压。 血浆中低分子晶体物质的含量约为0.7%,高分子胶体物质的含量约为7%.虽然高分子胶体物质的百分含量高,它们的相对分子质量却很大,因此,它们的粒子数很少.低分子晶体物质在血浆中含量虽然很低,但由于相对分子质量很小,多数又可离解成离子,因此粒子数较多.所以,血浆总渗透压绝大部分是由低分子的晶体物质产生的.在37℃时,血浆总渗透压约为769.9kPa,其中胶体渗透压仅为2.9~4.0kPa. 人体内半透膜的通透性不同,晶体渗透压和胶体渗透压在维持体内水盐平衡功能上也不相同。胶体渗透压虽然很小,但在体内起着重要的调节作用。 细胞膜是体内的一种半透膜,它将细胞内和细胞外液隔开,并只让水分子自由透过膜内外,而K+、Na+则不易自由通过。因此,水在细胞内外的流通,就要受到盐所产生的晶体渗透压的影响。晶体渗透压对维持细胞内外水分的相对平衡起着重要作用。临床上常用晶体物质的溶液来纠正某些疾病所引起的水盐失调。例如,人体由于某种原因而缺水时,细胞外液中盐的浓度将相对升高,晶体渗透压增大,于是使细胞内液的水分通过细胞膜向细胞外液渗透,造成细胞内液失水。如果大量饮水或者输入过多的葡萄糖溶液,则使细胞外液盐浓度降低,晶体渗透压减小,细胞外液中的水分向细胞内液中渗透,严重时可产生水中毒。高温作业之所以饮用盐汽水,就是为了保持细胞外液晶体渗透压的恒定。 毛细血管壁也是体内的一种半透膜,它与细胞膜不同,它间隔着血浆和组织间液,可以让低分子如水、葡萄糖、尿素、氢基酸及各种离子自由透过,而不允许高分子蛋白质通过。所以,晶体渗透压对维持血液与组织间液之间的水盐平衡不起作用。如果由于某种原因造成血浆中蛋白质减少时,血浆的胶体渗透压就会降低,血浆中的水就通过毛细血管壁进入组织间液,致使血容量降低而组织液增多,这是形成水肿的原因之一。临床上对大面积烧伤,或者由于失血而造成血容量降低的患者进行补液时,除补以生理盐水外,同时还需要输入血浆或右旋糖酐等代血浆,以恢复血浆的胶体渗透压和增加血容量。
第一章 溶液 第一节 溶解度 第二节 溶液的组成量度 第三节 溶液的渗透压(当前页) 第二章 电解质溶液 第一节 电解质在溶液中的离解 第二节 酸碱质子理论 第一节 沉淀-溶解平衡 第三章 PH值与缓冲溶液 第一节 水的离子积和溶液的PH值 …… |
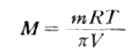 (1-6)
(1-6)