|
《医学遗传学基础》 > 第五章 多基因病
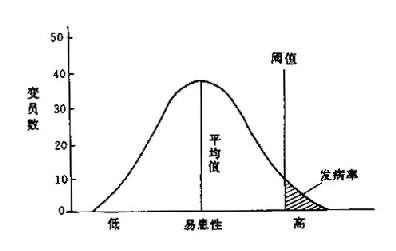
第二节 多基因病一些常见的先天畸形(congenitalmaiformation)和常见而病因复杂的疾病,其发病率一般都超过1/1000,疾病的发生都有一定的遗传基础,并常出现家族倾向,但不是单基因遗传,患者同胞的发病率不遵循1/2或1/4的规律,大约仅1%-10%,表明这些疾病有多基因遗传基础,故称为多基因病(polygenic disease)。正因为它们的遗传基础很复杂,属于复杂遗传病(complexgenetic disease)。 1.易患性与发病阈值多因子遗传性状和多基因病是由基因与环境因素共同作用的。决定一个个体是否易于患病的基础,称为易患性(liability)。易患性的变异与多基因遗传性状一样,在群体中呈正态分布,即群体中大多数个体的易患性近似平均值,易患性很高或很低的都很少。当一个体的易患性达到一定程度,即阈值(threshold),这种个体就要患病。因此,易患性的变异在群体中的分布就被阈值分为两部分:大部分为正常个体,小部分为患者。阈值代表在一定条件下患病所必需的、最低的易患基因的数量(图5-3)。
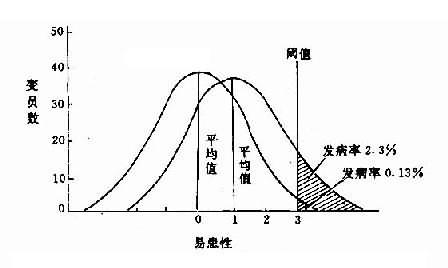
图5-3 群体中易患性变异与阈值图解 虽然就一个个体来说,易患性难以测定,只能依其婚后所生子女病情况作出粗略估计,但一个群体的易患性则可由该群体的发病率(即超过阈值部分)作出估计。其估量的尺度以正态分布的标准差为单位,就是在正态分布中,以平均值为0,在±1个标准差(0)范围内的面积占曲线内总面积的68%,以外的面积的占32%,两边各占16%。如此类推,在±2个标准差以内面积占总面积的95.4%,标准差以外的面积占4.6%,两边各占2.3%;在±3个标准差时,标准差以内面积占总面积的99.74%,以外面积占0.26%,两边各占0.13%。多基因病的易患性阈值与平均值距离越近,其群体易患性的平均值越高,阈值越低,则群体发病率也越高。反之,两者距离越远,其群体易患性平均值越低;阈值越高,则群体发病率越低。因此,可从群体发病率的高低计算出阈值与平均值之间的距离。图5-4表示易患性阈值和平均值距离与发病率的关系。 2,遗传率 遗传率是为了衡量多基因遗传中遗传因素与环境因素两者的相对作用大小而提出的。遗传率(或遗传度,heritability)是指在疾病发生中,遗传基础所起作用的大小。遗传率一般用百分率(%)来表示。一种遗传病如果完全由遗传基础决定,其遗传率就是100%,当然这种情况很少见。在多基因病中,遗传率可高达70%-80%,这表明其遗传基础在决定易患性变异和发病上起着重要作用,而环境因素的影响较小;反之,遗传因素是次要的。遗传率的计算可用变量分析方法进行。
图5-4 易患性阈值、平均值距离与发病率的关系图解 3.某些先天畸形 大约2%的新生儿存在严重的畸形,但多数尚能存活,其中很多畸形,如泌尿生殖系、脊椎和心脏的缺陷,在童年或青少年时已可鉴别诊断。 先天畸形的病因既有遗传因素,也有环境因素,还有两者共同的作用,故后者属于多基因遗传。后者是这些畸形最常见的病因,但在所有畸形中至少有40%的确实原因尚不知晓。少数遗传性畸形已证明是由于生化异常。如Ⅰ型成骨不全,已从患者皮肤成纤维细胞中测知其Ⅰ型胶原中的异常的a2链,这是骨骼发育异常的常染色体显性遗传病。还有诸多染色体异常引起的先天畸形不再赘述。 多基因遗传引起的畸形,遗传和环境因素都有影响,诸如社会经济原因对母体及其子宫的影响均可导致畸形的产生。常见的这类先天畸形有脊椎裂、唇裂、腭裂、短指或缺指、先天性心脏病、先天性幽门狭窄、先天性髋脱臼、先天性肾缺乏、先天性巨结肠症等。举几例简述如下。 (1)先天性心脏缺陷(congenital heart defects, CHDs):是一种很常见的先天畸形,在新生婴儿中发病率4%-8%,其原因是异质性的,有单基因或染色体异常引起的,也有因风疹病毒感染母体或糖尿病而引起的,大多数的病因不清。由于其类型较多,群体发病率及经验风险率也不一样。据多因子阈值模型所示,其一级亲属风险率是多因子性状的群体发病率的平方根据。表5-2示各种心脏缺陷畸形在群体和同胞中的发病率(表5-2)。 表5-2 主要先天性心脏缺陷在群体及同胞中的发病率
(2) 先天性单侧缺如(congenital absence of one kidney):约1/700婴儿患此病。大多数患者无症状,但伴发输尿管和结肠畸形者发病率高。如输尿管肾盂连接部狭窄,易感染,或发生高血压等。受累女性可伴有双角子宫或同侧半子宫缺如,受累男性伴有同侧输精管缺如。患者父母所生的子女侧肾发育不全的风险增高。 (3)短指畸形E型(brachydactyly,type E):由于骨骺未成熟闭合,病人手和脚变短并伴有第1、4和5掌骨、骨和拇指及趾的趾骨变短。患者身材矮小,青少年还伴有严重高血压。 (4)脊柱裂(spina bifida):受累的男性女性都可活到成年,通常智力正常,但都可能不育。受累成人的子女具有神经管缺陷的风险大约增高3%。 (5)先天性巨结肠(Hirschsprung’s disease):一般男性多于女性,但女性病人的子女中受累者风险较高。最近,已于染色体10q上将此病有关基因克隆。 由多基因所致的畸形患者,同胞及子女的患病风险增高,再发风险一般在1%-10%之间,比一般群体中畸形发病率高10-40倍,见表5-3。 表5-3 多基因遗传畸形患者的子女受累的风险
4.某些多基因遗传的常见病 成人许多常见的慢性疾病,如原发性高血压、糖尿病、动脉粥样硬化、冠心病、精神分裂症、哮喘病等都属于多基因病。这类疾病发病既有多基因遗传基础又有环境因素。如在任何一个体中,有特殊的大量致病基因,潜在发病危险性就大。当一个个体继承了危险基因的正常组合,他(她)们通过“危险阈值”时,环境因素就可决定疾病的表达和严重性,如图5-5。 要使其家庭成员患同一种疾病,该个体必须继承相同或极相似的基因组合,这种情况发生的可能性在一级亲属中明显大于较远的亲属。多基因遗传的易患性必须服从于基因控制特定功能的特异蛋白质合成这个基本事实。
图5-5 多基因病在群体及各级亲属中的闰病率 (1)冠状动脉病(coronary artery disease, CAD):大多数病例为有明显环境因素作用的多基因遗传病。CAD不仅有单基因病因,还伴有许多其它非遗传性和遗传风险因素。遗传因素如男性、家族史、高脂血症、高血压、糖尿病、肥胖症等;非遗传因素如吸烟、不活动、精神紧张等,因而增高了患该病的风险。 CAD患者大多在45岁以上,男性有较高的风险,这在群体和受累家族中都是如此。而当女性为先证者时,其亲属中的再发风险较高(表5-4)。 表5-4式CAD男女性先证者与死亡风险关系
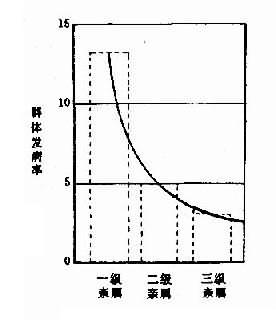
(2)高血压病(hypertension):它是一种复杂的多基因遗传病。在我国高血压病的患者高达8000余万人,近十年来升高约25%。高血压病具有家族聚集现象和复杂的遗传方式,其遗传率约为30%-60%。分子遗传学研究表明,该病和两个重要的基因,即血管紧张素转化酶基因(angiotensin converting enzyme,ACE1)和血管紧张素原基因(angiotensinogen,AGT)有关。ACE1的产物是血管紧张素Ⅱ(angiotensinⅡ),它与血管的构建和细胞生长有关,并决定血压、体液和离子的稳定性。血管紧张素原是血管紧张素Ⅱ的前体,AGT的增加,也伴随血管紧张素Ⅱ相应提高。某些激素对血压的影响也是通过AGT而实现的。最近证明AGT基因与高血压连锁,高血压时局部AGT水平增高。在高血压病的发病中,环境因素(精神紧张、高盐食物等)也是众所周知的。 (3)糖尿病(diabetes mellitus):本病是胰岛缺乏引起的常见代谢性疾病。按对胰岛素的需要量分为胰岛素依赖型糖尿病(IDDM)和非胰岛素依赖性糖尿病(NIDDM)两个类型。其特征为血糖升高、糖尿、糖耐量降低和胰岛素释放反应异常。临床上患者多食、多饮、随病程进展可出现心血管、肾、眼及周围神经等病变。一般认为是多基因病。近年用糖尿病大白鼠模型研究,认为该病可能与3个以上基因有关。 目前对多基因的常见复杂病的遗传基础研究非常引人注目,且进展迅速。许多事实证明多因子疾病中存在着单基因的遗传形式(monogenic forms of multifactorialdiseases)这是多基因遗传病研究非常重要的发展趋向。 5.多基因病的一些特点 综上所述,可见多基因病有如下特点: (1)家族聚集倾向,但无明显的遗传方式。因为在系谱分析中,它们不符合单基因遗传方式,同胞中发病率远低于1/2或1/4,既不符合常染色体显性和隐性遗传,也不符合X连锁遗传,但这些疾病及其在子代的再发风险,确实表现出家族性聚集倾向。 (2)随亲属级别的降低,患者亲属发病风险迅速下降,在发病率低的疾病,这个特点更为明显。表5-5和图5-6说明一些多基因病患者不同级别亲属发病风险的比较和由阈值模型得出亲属级别发病风险的理论曲线。 表5-5 某些多基因遗传病患者不同级别亲属的发病风险比较
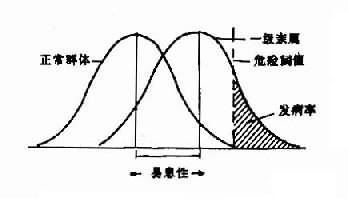
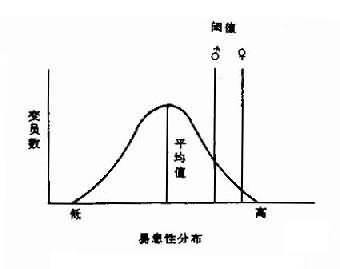
(3)近亲婚配时,子女患病风险增高,但不如常染色体隐性遗传显著,这可能与多因子的积累效应有关。 (4)畸形越重,再现风险越大,这说明遗传因素起着重要作用。 (5)当一种多基因性状频率在不同性别有明显差异时,表明发病率高的性别其阈值低,发病率低者其阈值高。图5-7表明先天性幽门狭窄由于性别不同的阈值差异的易患性分布,
←易患性→ 图5-6多基因遗传阈值模型
易患性分布 图5-7 有性别差异阈值的易患 即群体发病率低的性别患者,只有他们带有相当多的易患性基因时,其易患性才能超过阈值而发病。如果他们已发病,就表明他们已带有相当多的易患性基因,其后代中发病风险将较低,尤其是与其性别相反的后代。群体发病率高的性别患者,其后代中发病风险将较低,尤其是发病率低的性别的后代。先天性幽门狭窄患者,男性发病率是女性的5倍(男0.005,女0.001)。如为男性患者,儿子发病风险为5.5%,女儿发病风险为2.4%;相反,如为女性患者,她儿子的发病风险为19.4%,女儿风险为7.3%。
…… 第一节 基因突变致蛋白质合成异常 第二节 基因突变致酶活性异常 第三节 遗传多态现象 第五章 多基因病 第一节 多基因遗传与数量遗传 第二节 多基因病(当前页) 第一节 多基因病复发风险估计 第六章 群体遗传学 第一节 群体中的遗传平衡 第二节 突变和选择 …… |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||