|
《动脉粥样硬化》 > 第十九章 载脂蛋白表型及基因型的检测
第二节 载脂蛋白E表型ApoE是一种含有299个氨基酸的单链多肽糖蛋白(Mr34200),主要存在于CM、VLDL和HDL中。 1975年Utermann等将脱脂的VLDL进行IEF电泳时,首先提示ApoE多态性的存在。ApoE多态性的产生是由于其一个遗传位点上的3个主要等位基因ε2、ε3、ε4所编码的3种主要ApoE异构体E2、E3、E4之间单个氨基酸替换及其与四种受体的亲和力不同。人群中有6种不同的ApoE表型:三种纯合子(E2/2、E3/3、E4/4)和三种杂合子(E3/2、E4/2、E4/3)。ApoE3是人群中最常出现的形式,常被称为“野生型”(Wild-type),其多肽链112位和158位均为Arg。 ApoE多态性主要由其基因多态性所决定,另外也受到翻译后化学修饰的影响。许多研究资料表明,ApoE多态性不仅CHD、AS的发生发展及危险性密切相关,而且与Alzheimer病(AD)发生有关联,这些领域的研究已引起人们广泛关注与浓厚兴趣。许多临床及研究实验室对比进行了广泛的研究,依据被检查病人的类型,已建立了几种快速准确测定ApoE表型的方法。
一、ApoE表型检测的方法学ApoE表型检测即可以以VLDL为样品,又可以直接以血清(或血浆)为样品,通过IEF电泳分析、双向PAGE或结合免疫印迹法进行测定。 1.等电聚焦(IEF):由于三种主要ApoE异构体E2、E3和E4的等电点(pⅠ)分别为5.89、6.02和6.68,E4比E3多一个正电荷,而E2比E3少一个正电荷。因此,可应用1EF检测这些异构体间电荷差异而确定不同ApoE表型。传统ApoE表型检测方法多采用超速离心法或化学沉淀法分离VLDL,脱脂后进行IEF,然后进行染色分析。这种方法需要血清量较多,昂贵、费时,又需要大型设备,不适合大规模研究。ApoE异构体之间染色程度之间差异及电泳过程中泳动距离的变异性也造成结果的不稳定性。 2.免疫印迹法(immunoblotting):血清脱脂后,经IEF电泳将ApoE与其他蛋白质分离,然后将凝胶中蛋白质转移到硝酸纤维素(NC)膜上,用抗ApoE抗体作为一抗进行免疫印迹反应或采用直接的免疫固定法,即可灵敏而特异地显示出ApoE区带的位置,从而确定ApoE表型。此方法利用抗原-抗体的特异反应,排除了血清其他蛋白质的干扰,不需超速离心分离VLDL,血清用量少,是国内外实验室检测ApoE表型常用的方法之一。但此类方法亦存在一些缺点,如对于存在与普遍异构体具有相同电荷的罕见异构体标本,或在糖尿病等病理状态时,由于转录后修饰引起蛋白质变化的标本检测时,就会给出错误的结果。 3.双相电泳(two-dimensionalelectrophoresis) 第一相应用IEF电泳将等电点不同的蛋白质分离;第二相根据蛋白质分子量不同及浓度的差异,应用SDS-PAGE进行分离,由此确定ApoE表型。此技术能解决IEF遇到的一些转录后修饰的问题,临床标本用量也很少,并且可以同时进行定性和定量分析,但由于成本昂贵而且费时,有时也难以清晰地分辨表型,故临床上应用较少。
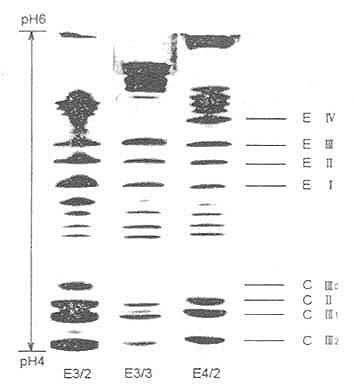
二、IEF电泳检测ApoE表型本法以VLDL为测定样品。首先利用超速离心机自血清中分离VLDL,一方面可去除血清杂蛋白的干扰,另一方面也可达到富集ApoE的作用,因ApoE主要存在于VLDL。 1.仪器与试剂 电泳仪,垂直板式电泳槽,超速离心机,光密度计,大培养皿;主要试剂有:①1.00g/mlNaBr与1.20g/ml NaBr溶液;②脱脂液为乙醇/乙醚混合液(3:1,V/V);③样品溶解液为0.01mol/l Tris-HCl,pH8.2,内含1%SDS,5%β-巯基乙醇及13%蔗糖;④凝胶贮存液;丙烯酰胺(Acr)30g,NN’-甲叉双丙烯酰胺(Bis)1.2g,加水至100ml;⑤电极缓冲液:0.01mol/lH3PO4(阳极),0.02mol/L NaCl(阴极);⑥凝胶应用液:PAG浓度为7.5%,内含1.6%两性电解质载体(Ampholyte,pH4.0~6.5,Pharmacia);⑦0.2%CBBG250染色液;⑧脱色液:甲醇/水/乙酸溶液(5:5:1,V/V)。 2,实验方法 ①人血清VLDL的分离;取血清3.0ml,加入固体NaBr使其密度增加至1.30g/ml。在BeckmanL8-80离心机Ti80转头离心管中依次加入密度为1.00g/ml,1.20g/ml的NaBr溶液和1.30g/ml的血清样品,形成1.00~1.30g/ml的不连续密度梯度。10℃,70000r/min超速离心2h,离心后在管顶层可见白色乳状液体,此即为VLDL,小心收集0.3~0.5ml并转移至已准备好的脱脂管内脱脂。②VLDL的脱脂:按Scanu(1971)法进行。先用3:1(V/V)乙醇/乙醚混合液在-20℃脱脂两次,每次9~12h,继用乙醚脱脂1次,2h。每次脱脂后在-15℃离心收集沉淀,3000r/min,15min。末次离心后在管中加入0.01mol/l Tris-HCl,pH8.2,内含1%SDS,2%两性电解质载体,5%β-巯基乙醇及13%蔗糖的溶液60μl,并在室温下孵育30min,最后用氮气吹尽残存的乙醚,此即为IEF电泳的样品。③IEF电泳:按Menzel等(1983)法进行。垂直板PAG浓度为7.5%,内含1.6%pH4.0~6.5的两性电解质载体。电泳凝胶用0.2%CBBG250染色。脱色后至图像清晰后照像扫描。④ApoE表型判定:根据电泳图谱,依据E2、E3、E4各区带光密度比例确认ApoE各表型,如图19-3和表19-1所示。
图19-3 VLDL的IEF-PAGE图 表19-1ApoE表型的鉴定
由于ApoE即有主要异构体,又有次要异构体,有时使表型确定较为困难。一般情况下,应用此法较易确定ApoE纯合子表型,但对于某些杂合子表型的判定要慎重,往往要在色带经过光密度扫描以后,根据两条色带颜色深浅之比才能最后定论。如仍难以确定时,可用唾液酸酶处理VLDL,使次要异构体减少或消失,而有利于表型的判定。
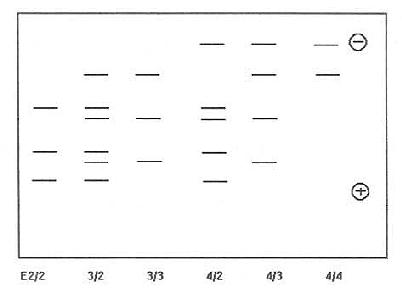
三、免疫印迹法检测ApoE表型由于IEF法需大型设备,工作量较大,极大地限制了该法的临床应用。免疫印迹法为目前检测ApoE表型最常用方法。此法直接用血清(或血浆)作为样品,脱脂后进行IEF电泳,然后用特异性多克隆或单克隆抗体进行免疫印迹反应,根据黑色后图谱即可确定ApoE表型。此法比IEF法更省时、简便、准确。 1.仪器与试剂 电泳仪,垂直板式电泳槽,转移电泳槽,NC膜;主要试剂有:⑴3:1(V/V)乙醚脱脂液;⑵样品溶解液;0.01mol/l Tris,pH8.6,内含0.01mol/LDTT,8mol/L尿素;⑶两性电解质(Ampholine,pH4~6,LKB产品);⑷丙烯酰胺(Acr)、N-N'甲叉双丙烯酰胺(Bis),Serva产品;⑸TEMED(Sigma产品);⑹电泳缓冲液:1mol/lNaOH,1mol/L H3PO4;⑺转移电泳缓冲液:含20%甲醇,39mmol/L甘氨酸,48mmol/lTris和0.0375%SDS;⑻洗涤液(TPBS)含0.05%吐温-20,0.9%NaCl的10mmol/LPBS,pH7.4;⑼封闭液:含0.18%兔血清的TPBS或含3%BSA的TPBS;⑽羊抗人ApoE多克隆抗血清;⑾HRP标记的兔抗羊IgG:⑿4-氯-1-萘酚(Sigma产品)。 2.实验方法 (1)样品处理:抽取空腹血1~2ml,分离血清。取血清10μ置于预冷乙醇/乙醚(3:1)脱脂液中-20℃脱10h以上,离心(2500r/min)15min,弃上清后的加等量预冷的无水乙醚继续脱脂0.5h,再次离心,将沉淀样品用氮气吹干或抽真空使残余乙醚挥发;(2)IEF电泳:电泳前将样本溶解在100μl溶解液中(0.01mol/l Tris,pH8.6,内含0.01mol/LDTT,8mol/L尿素),放置37℃,1h。PAG凝胶浓度为5%,内含尿素(8mol/L),2%Ampholine,0.025%过硫酸胺(AP)及0.033%TEMED。电极液:阴极为1mol/LNaOH,阳极为1mol/LH3PO4。每份样品加样20μl,IEF条件初为300V,0.5h,然后调至700V,电泳5h。或1000V预冰30min(10℃)后,关电源,在靠阴极处放上IEF加样箔,每一空内加样后,继续电泳2h30min;(3)免疫印迹:转移电泳条件18V/cm,按转移电泳槽要求将凝胶上的蛋白电泳转移到NC膜上。5h后取出NC膜,放入封闭液内,室温过夜。用TPBS洗3次,然后用羊抗人ApoE抗血清(1:2000TPBS稀释)室温孵育6h。倾去液体,充分洗涤后,加入HRP标记的兔抗羊IgG(1:200)室温孵育2h。用PBS洗膜3次,每次10min。称取12mg4-氯-1-萘酚溶在4ml冷甲醇(-20℃)中,放入20mlPBS,加入10μ130%H2O2,放入已洗净的NC膜,缓缓摇动至蛋白带显出,蒸馏水洗后,晾干,暗处保存;(4)ApoE表型判定:根据所显示ApoE区带图谱即可确定ApoE表型,见图19-4所示。
图19-4 6种ApoE表型免疫印迹图(模式) 此方法样品用量少(10~20μl血清即可),故特别适合临床检验与大规模人群调查。由于ApoE糖类含量会影响IEF结果,所以在IEF前常用唾液酸酶预处理标本,以除去唾液酸残基。唾液酸酶的处理加强了主要区带,减弱了干扰的唾液酸型区带,克服了未用酶处理时,E3/2和E3/3有时难以分辨的困难,提高了表型判别的准确性。另外,如选用pH4~8范围的梯度作IEF电泳,则几乎能检测出至今为止所发现的所有异构体表型。国内吕新跃等应用自制E6C3株ApoE单克隆抗体作为一抗,用兔抗鼠IgG-辣根过氧化物酶标二抗,建立微量脱脂血清IEF及免疫印迹检测ApoE表型,亦取得较好效果。
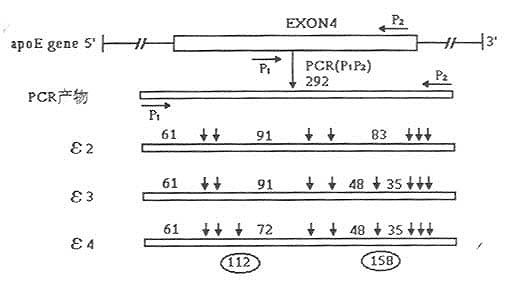
四、ApoE基因型的检测采用聚合酶链反应(PCR)限制性片段长度多态性(RFLP),即PCR-RFLP技术从基因水平检测ApoE基因多态性(基因型),操作简便、快速准确。 1.仪器与试剂 (1)仪器:电泳仪、基因扩增仪; (2)试剂:Taq DNA聚合酶、dNTPs、DNA参考物(pBR322DNA/HacⅢmarkers)、HhaⅠ,其余试剂均为分析纯。 2.实验方法 (1)引物的设计与合成:引物参考文献设计,由Ranson Hill Bio Ssience Inc合成。序列为P1:5’-AACAACTGACCCCGGTGGCG-3’;P2:5’-ATGGCGCTGAGGCCGCGCTC-3’。特异性扩增ApoE基因第4外显子区含编码112位与158位氨基酸的基因序列(如图19-5)。产物片段292bp。
图19-5 PCR扩增产物经HhaⅠ酶切后RFLP模式 (2)模板DNA提取 ①经典法,取全血100μl,蛋白酶K消化,按标准酚、氯仿、异戊醇法提取DNA;②碘化钠法,参照Loparev等法加以改良,取全血100μl加无菌双蒸水100μl混匀,加6mol/lNaⅠ200μl涡旋震荡30秒,加等体积氯仿/异戊醇(24:1),涡旋震荡30秒,离心后取上清加0.6体积异丙醇混匀,室温(或4℃)静置15min,离心后沉淀以37%异丙醇洗1次,晾干后溶于TE中。以上两法提取DNA经紫外分光光度计定量后,置-20℃保存备用;③微量血斑水煮法,取50μl全血点至无菌滤纸上,自然干燥后用甲醇固定,室温贮存。临用时,剪成一直径5mm的圆形血斑纸块,将其混至100μl无菌双蒸水中,100℃煮沸30min以裂解细胞。取混合物15μl作膜板用。 (3)PCR扩增;反应体系为50μl。其中含1×扩增缓冲液(Tris-HC167mmol,pH8.3;MgCl225mmol/L;KCl50mmol/L)5μl,1%二甲亚砜5μl,dNTP各200μmol/L(5μl),引物P1、P2各5μl(分别为0.5μmol/L,模板DNA200mg(5μl),双蒸水15μl,加石蜡油30μl,离心混匀,置热循环仪(PE2400型,Perkin Elmer Cetus)中95℃预变性12min后,再加入TaqDNA聚合酶2U(5μl),然后按下列程序循环35次,即94℃变性1min,65℃退火1min,72℃延伸1.5min,最后于72℃再延伸10min,取产物10μl经2%琼脂糖凝胶电泳(溴化乙啶),紫外灯下观察扩增为292bp。 (4)扩增产物的限制性酶切:PCR扩增产物17μl直接用10UHhaⅠ酶切,37℃消化4h。反应终止后产物经10%聚丙烯酰胺凝胶电泳,EB染色35min,以DNA片段长度标准物为参考,紫外灯下观察结果并照像。ApoE基因型判定参照Richard等方法加以简化,即ε2/2出现3条带(91bp,83bp,61bp),ε3/2出现5条带(91bp,83bp,61bp,48bp,35bp),ε3/3出现4条带(91bp,61bp,48bp,35bp),ε4/3出现5条带(91bp,83bp,61bp,48bp,35bp),(91bp,72bp,61bp,48bp,35bp),ε4/2出现6条带(91bp,83bp,72bp,61bp,48bp,35bp),ε4/4出现4条带(72bp,61bp,48bp,35bp)。 该法检测的ApoE基因型图谱如表19-2所示。表中所示动脉粥样硬化性脑梗死(ABI)。 表19-2 人ApoE基因型和等位基因频率分布(%)
*:P<0.05;**P<0.01(均与对照组比较) 病人ε4/3基因型频率(30.0%)与ε4等位基因频率(18.0%)均显著高于健康对照组。
五、ApoE表型检测的临床意义临床上对ApoE表型多态性的研究已有20多年的历史,许多研究表明,ApoE多态性与个体患冠心病(CHD)或脑卒中可能存在某种内在联系。1993年以来,又发现ApoE多态性与AD及老化有关。通过对不同人群ApoE表型频率分布差异、ApoE多态性对血脂水平的影响及在某些疾病状态时ApoE等位基因频率分布的系统深入研究,已取得许多研究成果。 1.人群ApoE表型人群中存在六种ApoE表型,其由位于一个基因位点的三个共显性等位基因所控制。正常人群中以E3/3表型频率最高(超过50%);含E3的杂合子(E4/3、E3/2)居中(二者之和超过20%);E2/2、E4/4和E4/2表型频率最低(三者之和不超过8%)。 2.ApoE表型分布ApoE表型与等位基因频率分布具有一定种族差异性(如表19-3),无性别差异。中国人与日本人群十分相似,E3频率均高于80%,而欧美人群均低于80%。欧洲人E4等位基因频率从北到南呈下降梯度分布,亚洲人E4频率低(4.9%~12.7%),相比之下,非洲黑人及巴布亚新几内亚人E4频率高(约分别为30%、36.8%)。 表19-3 不同国家人群ApoE表型及等位基因频率分布
3.ApoE表型与高脂血症 ApoE多态性可能与不同的高脂血症(HLP)、CHD发生的种族差异及家族倾向有关。已发现Ⅲ型HLP患者几乎无例外的均为E2/2表型,易早发严重的AS。V型HLP患者ApoE4含量比正常人高。CHD患者E4/3表型和E4基因频率明显高于正常对照组。ε4与高TC、高LDL-C和高ApoB水平密切相关,可能是高胆固醇血症和CHD的遗传易患因子。 4.ApoE表型与脑病 ApoE多态性与缺血性脑血管病(ICVD)关系密切。Pedro-Botet等研究发现ICVD组E4/3表型频率明显高于对照组,E3/3表型频率明显低于对照组,认为ε4基因可能是ICVD的一种遗传标记。而Couderc等采用病例一对照的方法研究认为ICVD组E3/3表型频率明显低于对照组,而E3/2明显高于对照组,认为ε2基因可能是ICVD的危险因素。这些结论之间的差异可能与研究方法、所选病例及研究人群之间差异有关。 5.ApoE表型与AD ApoE多态性是Alzheimer病(AD)危险性的重要决定因子。Shimaro等(1989)首先描述AD与ε4的关系,他们运用IEF研究发现AD患者ε4频率比对照组高2倍。此后,Rose研究组等相继报道迟发性家族性AD(FAD)病人ε4频率增高,都描述、证实和讨论了ε4与AD的关系。Schachter等(1994)率先报道百岁老人普遍拎携带ε2等位基因。高龄老人携带ε2数量是年轻人的2倍。因此,ε2基因似乎不仅可保护人们免患AD,而且还与长寿有关。
…… 第四节 免疫火箭电泳法 第五节 免疫透行射比浊法 (血清载脂蛋白的免疫测定)参考文献 第十九章 载脂蛋白表型及基因型的检测 第一节 载脂蛋白(a)表型 第二节 载脂蛋白E表型(当前页) 第三节 载脂蛋白B基因多态性的检测 第四节 载脂蛋白CⅢ基因型检测 (载脂蛋白表型及基因型的检测)参考文献 第二十章 低密度脂蛋白受体的检测 …… |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||