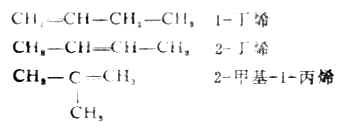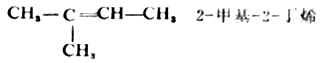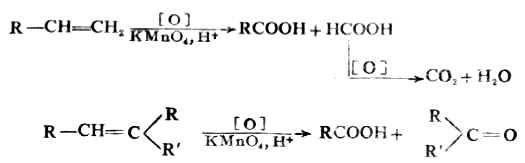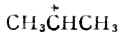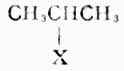|
《医用化学》 > 第十一章 链烃
第二节 烯烃
一、烯烃的构造和通式烯烃是指一类含有碳碳双键( 烯烃分子中不是所有碳原子的价都饱和了,因 此它又称为不饱和烯。根据碳碳双键的数目,烯烃又可以分为单烯烃(含一个双键)、二烯烃(含两个双键)和多烯烃(含多个双键)。其中以单烯烃和共轭二烯烃最为重要。平时“烯烃”这个名字是代表单烯烃的意思,所以通常烯烃是指含有一个碳碳双键的不饱和烃而言。烯烃的通式是CnH2n。碳碳双键( 烯烃的碳碳双键(
二、烯烃的同分异构现象(一)构造异构 由于存在双键,使烯烃的异构体数目比相应的烷烃多。如丁烷只有两种同分异构体,而分子式为C4H8的丁烯则有三种构造异构体。
在烯烃的构造异构体中,有一种是碳链异构,即骨架不同的异构现象。如1-丁烯(或2-丁烯)与2-甲基-1-丙烯;另一种是由于双键的位置不同,如1-丁烯和2-丁烯。这种由于官能团位置的不同而产生的异构现象叫做位置异构。碳链异构与位置异构都属于构造异构。 (二)顺反异构 除上述两种异构现象外,由于以双键相连的两个碳原子不能绕σ键轴自由旋转,所以当两个碳原子上各连有两个不同的原子或基团时(如2-丁烯),双键上的四个基团在空间就可以有两种不同的排列方式,即两种构型。
这两个异构体在原子或基团的连接顺序及官能团的位置上均无区别,即构造相同;它们的区别仅在于基团在空间的排列方式不同。在前一个化合物(Ⅰ)中,相同的基团(两个甲基或两个氢原子)在双键的同侧,叫做顺式异构体(词头cis-系拉丁字,意指在一边),而后者(Ⅱ)的两个甲基(或两个氢原子)则在双键的两侧,所以叫做反式异构体(词头trans-系拉丁字,意指交叉)。这种异构现象叫做顺反异构,是立体异构的一种,属于构型异构。立体异构是构造相同,但分子中的原子或原子团在空间排布不同的同分异构现象。构型异构是立体异构中的一种,是构造相同,构型不同的立体异构现象。 顺反异构体是两种不同的化合物。顺反异构体不仅在理化性质上不同,它们的生理活性也往往有差异,如具有降血脂作用的亚油酸,它的两个双键都是顺式构型。
三、烯烃的命名法烯烃的系统命名法的关键也是如何选择母体化合物和如何确定取代基的位置。 1.选择含有双键的最长碳链为主链作为母体。主链上的碳原子从靠近双键的一端开始编号,并把双键位置写在烯烃名称的前面。
2.把支链作为取代基,其位置、数目和名称按“次序规则”(见后)“较优”者后列出的顺序写在某烯之前。
3.如双键在主链的中央,则编号从靠近取代基的一端开始。
4.烯烃主链上的碳原子在十个以上时,烯字的前面应加一个“碳”字。
烯烃去掉一个氢原子生成一价基团,叫做烯基。碳链的编号应从含有自由键的碳原子开始。例如:
5.对于双键碳原子上连结有四个不同取代基的烯烃,其顺反异构体如用相同基团在双键的同侧或异侧的方法命名则遇到困难,例如:
这时应根据Cahn-Ingold-Prelog的顺序规则对顺反异构体命名。次序规则是为了表达某些立体化学关系,须决定有关原子或原子团的排列次序时所用的方法。其主要内容如下: (1) 将各种取代基的原子(与C=C的碳相连的原子)按原子序数大小排列,大者为“较优”基团。例如:I>Br>Cl>S>P>O>N>C>H(“>”表示“优于”)。 (CH3)2C->(CH3)2CH->CH3CH2->CH3- 假使第二个原子也相同时,则沿取代链逐次相比。例如:
此外应注意:一个原子序数大的原子要比两个或三个原子数小的原子优先,例如: -CH2CL>-C(CH3)3 因此,此规则是比较原子序数的大小,而不是几个原子的原子序数之和。 (3)有双键或三键的基团:
根据上述规则,一此常见的原子及原子团的优先顺序是:I>Br>Cl>-SO3H>F>
按次序规则决定双键上每个碳所连的两个原子或原子团的优先次序后,在下式中,如a>b,c>d,则当a与c在参考平面(π键所在平面,即与 平面相垂直的平面)同侧 时,叫做Z型(Z取自德文Zusammen,在一起);当a与c在参考平面两侧时,叫做E型(E取自德文Entgegen,相反,相对)。Z,E写在括号里,放在化合物系统名称的前面。
例1
例2
四、烯烃的物理性质烯烃的物理性质如熔点、沸点、相对密度和溶解度等与相应的烷烃相似。常温时,C2~C4的烯烃是气体,C5~C18是液体,C18以上是固体。烯烃都难溶于水而易溶于有机溶剂。 表11-4 烯烃的物理常数
五、烯烃的化学性质烯烃的官能团是 与碳原子的结合不很牢固。由于烯烃具有易断裂和易极化的不稳定的π键,故使它具有不同于烷烃的特殊化学性质,如易发生加成、氧化、聚合等反应。 (一)加成反应 烯烃的加成反应是指在起反应时,烯烃分子中π键断裂,试剂中的两个原子或原子团分别加到双键的两个碳原子上的反应。双键加成的典型反应可表示为:
1.加氢 在普通情况下,烯烃与氢并不发生反应。如有适当的催化剂(Pt,Pd,Ni)存在,烯烃在液相或气相下能够氢化,变成相应的烷烃。例如:
这种在催化剂作用下的加氢反应,称为催化氢化。由于催化氢化反应可以定量地进行,所以可根据吸收量的计算来分析样品中双键的数目。 2.加卤素 烯烃与卤素(氯或溴)加成反应是亲电加成反应,这个反应在常温下就能很迅速地发生,例如:
如果用溴的四氯化碳溶液时,反应结束后溴的棕红色消失。常用这个方法来鉴定化合物是否含有碳碳双键。 3.加卤化氢 烯烃与卤化氢(HI,HBr,HCl)的加成反应也是亲电加成反应,生成卤代烷。例如:
对HX一类试剂,加在双键上的两部分(H与X)不一样,所以叫做不对称试剂。乙烯是对称烯烃,它和不对称试剂加成产物只有一种。若不对称试剂和不对称烯烃发生加成反应时,加成方式就有两种可能,例如,丙烯与氯化氢加成时,产物可能是:
得到的产物主要是(Ⅰ)。也就是当不对称烯烃和卤化氢加成时,氢原子主要加在含氢较多的双键碳原子上。这个经验规律叫做马尔可夫规则(Markovnikov`s rule),简称马氏规则。 (二)氧化反应 烯烃很容易被氧化,主要发生在π键上。首先是π键断裂,条件强烈时σ键也可断裂。随着氧化剂及反应条件的不同,氧化产物也不同。常用的氧化剂是高锰酸钾溶液。 烯烃与中性或碱性高锰酸钾溶液作用时,被氧化为邻二醇。
烯烃与酸性高锰酸钾溶液作用,碳链在双键处断裂,生成碳原子数较少的羧酸和酮等。例如:
用高锰酸钾氧化烯烃,可用以检验双键的存在,亦可推断烯烃中双键的位置等。 (三)聚合反应 烯烃不仅能和其它化合物起加成反应,特别是低级的1-烯烃,在一定的条件(如高温、高压、催化剂)下还可在多个相同(可相似)分子间发生自身加成。例如:
这种由低分子结合成更大分子的过程叫做聚合反应,生成的产物叫做聚合物或高聚物,进行聚合反应的原料烯烃称为单体。因为烯烃的聚合反应都是通过双键的断裂而使分子自相加成聚合起来,所以它又称加聚反应,简称加聚。 聚乙烯是白色或淡白色的固体物质,具有柔曲性、热塑性和弹性。聚乙烯的机械强度随制造方法而有所不同。高密度聚乙烯的韧性、抗张强度、耐热性以及对溶剂的抵抗能力均比低密度聚乙烯好。 聚乙烯塑料可作人工髋关节髋臼、输液容器、各种医用导管、整形材料和包装材料等。高聚物在医药上如人工材料等方面的应用,其意义也日渐增大。
六、烯烃的亲电加成反应历程(一)烯烃与卤素的加成 乙烯和溴的加成是亲电加成,加成过程如下:非极性的溴分子由于受乙烯π电子或极性条件(如微量的水、玻璃容器的器壁等)的影响而极化变成了偶极分子 。加成反应分两步进行。第一步
中带正电荷的 Brσ+部分进攻乙烯分子,使C=C中的π键变弱,Br-Br中的σ键也变弱,生成一个带正电荷的σ络合物——环状溴鎓离子及Br-。
第二步Br-从溴鎓离子的背面进攻,得加成产物。
用实验方法可以证明是Brσ+而不是Brσ-首先与烯烃加成。 在乙烯与溴加成反应中,第一步进行得较慢,是决定反应速率的步骤。第二步是带相反电荷的两个离子间结合,所以反应较快。由于决定反应的一步是由亲电试剂发动进攻的,所以该反应是亲电反应。又由于整个反应是加成反应,故叫做亲电加成反应。 (二)烯烃与卤化氢的加成 烯烃与卤化氢(HCl,HBr,HI)或浓的氢卤酸的加成也是亲电加成。卤化氢是极性分子( ),氢卤酸为H+X-。 加成反应的第一步是质子(H+)与烯烃生成碳正离子。这是决定反应速率的一步。
碳正离子中,带正电荷的碳是sp2杂化的,这个碳上有空的未参与杂化的p轨道。 第二步,X-与碳正离子结合,生成卤代烷 CH3CH2++X-→CH3CH3x 不对称烯烃(如丙烯)与HX的加成符合马氏规则。反应第一步生成的碳正离子有两种可能性:一种是(Ⅰ),即正电荷在中间一个碳原子(C-2)上;另一种是(Ⅱ),即正电荷在末端的碳原子(C-1)上。
实验表明,生成这两种碳正离子(Ⅰ及Ⅱ)所需的活化能不同,生成(Ⅰ)的活化能较小,生成(Ⅱ)的活化能较大;同时,(Ⅰ)与(Ⅱ)本身的能量大小也不一样,(Ⅰ)较小而(Ⅱ)较大。所以各种烷基碳正离子的稳定性次序为:3°>2°>1°>+CH3。2°碳正离子要比1°碳正离子更容易生成。也就是说异丙基碳正离子(Ⅰ)比丙基碳正离子(Ⅱ)更容易生成。因此,(Ⅰ)是丙烯与HX加成反应的主要中间体,即第二步反应的主产物是2-卤丙烷而不是1-卤丙烷。
七、诱导效应有机化合物的性质,不仅决定于分子中原子的组成、连接顺序和方式,而且决定于分子中原子间的相互影响和空间排布。一般把原子间的相互影响归结为电子效应和空间效应。电子效应说明改变分子中电子云的分布对物质所产生的影响;空间效应说明分子中的空间结构对性质的影响。电子效应又可分为诱导效应和共轭效应。 在一个分子中引入一个原子或原子团以后,与这个原子或原子团相连的原子之间键的极性,将影响到分子中的其它部分,使分子的电子云密度分布发生一定程度的改变。这表现在分子中发生了σ电子的转移。这种转移是由成键原子的电负性不同引起的,并通过静电诱导作用沿着原子链中的σ键向某一方向传递下去,原子间的这种相互影响叫做诱导效应(I效应)。 诱导效应的方向以C-H键作为比较标准(I效应=0)。当其它原子或原子团(X或Y)取代C-H的氢原子后,成键的电子云密度分布不同于C-H键。如果X的电负性大于氢原子,则当X取代氢后,C-X键的电子偏向X,产生偶极:
箭头指的方向是电子偏移的方向。与氢相比,X具有吸电子性,我们把它们叫做吸电子基。由它们所引起的诱导效应叫做吸电子诱导效应或亲电诱导效应,一般用-I表示。如果Y的电负性小于氢原子,则当Y取代后,C-Y键的电子向碳偏移。与氢相比,Y具有斥电子性,我们把它们叫做斥电子基。由它们所引起的诱导效应叫做斥电子诱导效应,或叫供电诱导效应,用+I表示。 在多原子分子中,+I或-I诱导效应都可以沿着分子中原子的链(σ键)由近及远地传递下去。例如:
但是,诱导效应将随着传递距离的增加而迅速地减弱,一般经过3~4个键以后,影响已经很小了。 诱导效应只是使共价键中的电子云密度由于电负性的差异而引起的定向偏移,并不改变各原子的电子层结构,故只产生局部的正负电荷。 根据实验结果,一些原子或原子团电负性大小的次序如下:
在H前面的原子或原子团是吸电子基,在H后面的是斥电子基。 上面所述的诱导效应是由分子内的静电作用产生的永久性的效应,由物质分子的结构所决定的,与外界条件无关,又叫做静态诱导效应。 马氏规则还可以用甲基的诱导效应来解释。丙烯是不对称烯烃,与乙烯不同。乙烯的双键的两个碳原子各连两个氢,其分子中π电子云的分布是均匀的。丙烯双键的两个碳原子中,有一个连两个氢,另一个连着氢和甲基。由于氢与甲基的电负性不同,氢的电负性大,甲基的电负性小,所以,丙烯分子中碳碳双键上的电子云密度比乙烯的大,同时π电子云的分布也不均匀:
式中的弯箭号“ ”表示一对π电子的转移方向,δ+及δ-表示双键两个碳原子上电荷的分布不均匀。因而,当亲电试剂H+向丙烯发动进攻时,其攻击部位是丙烯分子中带部分负电荷的碳。这样,生成的中间体是 ,加成的主要产物是 ,符合马氏规则。
…… 六、共价键参数 七、共价键的断裂和反应类型 八、有机化合物的分类 第十一章 链烃 第一节 烷烃 第二节 烯烃(当前页) 第三节 二烯烃 第四节 炔烃 第十二章 环烃 第一节 脂环烃 …… |