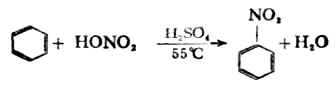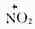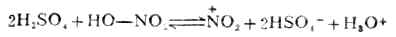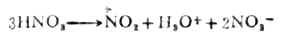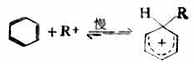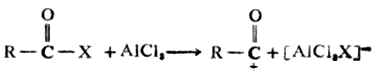|
《医用化学》 > 第十二章 环烃
第二节 芳香烃芳香烃科称芳烃,它是芳香族化合物的母体。这里所讲的芳香烃是指分子中含有苯环的烃类。苯是最简单最重要的芳香烃。 在芳香烃中,根据所含苯环数目的多少和连接方式,又可分为单环芳香烃和多环芳香烃两类。 单环芳香烃: 这类芳香烃分子中只含有一个苯环,如苯,甲苯、二甲苯等。
多环芳香烃: 分子中含有两个或两个以上的苯环,根据苯环的连接方式不同,又可分为三类: 多苯代脂烃这类芳香烃可看作是脂肪烃中两个或两个以上氢原子被苯取代的化合物,如二苯甲烷、三苯甲烷等。
联苯和联多苯分子中两个或两个以上的苯环直接互相连接,如联苯、多联苯等。
稠环芳香烃苯环通过共用相邻的碳原子相互稠合而成的芳香烃称为稠环芳香烃。如萘、蒽、菲等。
芳香烃是合成芳香族化合物的重要原料,而芳香族化合物又是医学、染料及国防等工业的重要物质。芳香烃主要来自石油C5-C8馏分的芳构化,即从石油加工中制取。
一、苯的结构根据元素分析和相对分子质量的测定,证明苯的分子式C6H6。由苯的分子式可见,碳氢比和乙炔相同,都是1:1,它应具有不饱和性,但是事实并非如此。苯极为稳定,不易氧化,难起加成反应,但在催化剂的作用下,易发生取代反应。由此证明,苯的性质与不饱和烃大有区别。苯的这种性质来自苯的特殊结构。 1865年凯库勒首先提出了苯的环状结构,即六个碳原子彼此连结成环,每个碳原子上都结合着一个氢原子。为了满足碳的四价,凯库勒提出如下的构造式:
凯库勒的这种环状构造式在一定程度上反映了客观事实,如苯在一定条件下,催化加氢生成环己烷。这说明了苯分子的六个碳原子结合成环状结构。但凯库勒式还不能解释分子中虽含有三个双键,为什么不出现与烯烃相类似的加成反应。另外,苯的邻位二元取代物只有一种,而凯库勒的构造式却能有两种。
为了解释这种情况,凯库勒认为分子中的单、双键不是固定的,它们可以相互转变。
多年来,人们对于苯提出了多种构造式,但还没有一种能比较完善地表示它的结构。 经过现代物理方法的研究,证明苯分子中的六个碳原子都是sp3杂化的。每个碳原子各以两个sp2杂化轨道分别与另外两个碳原子形成C-Cσ键。这样六个碳原子构成了一个正六边形的环状结构。每个碳原子上的另一个sp2轨道,其电子云的对称轴在正六边形的平面上,这个sp2杂化轨道与氢原子的1s轨道,其电子云的对称轴在正六边形的平面上,这个sp2杂化轨道与氢原子的1s轨道形成C-Hσ。因此苯人子中的所有原子都在一个平面上,键角都是120°[图12-(a)],每个碳原子还有一个未参与杂化的pz杂化轨道[图12-(b)],它的对称轴垂直于此平面,能与相邻的两个碳原子上的pz轨道分别从侧面平行重叠,形成了一个闭合的共轭体系[图12-5(c)],在这个体系中,环上有六个碳原子和六个π电子,离域的π电子云完全平均化,体系能量低,比较稳定。π电子云成两个轮胎状[图12-5(d)],均匀分布在苯环平面的上下两侧。苯分子中的碳-碳键长也完全平均化,都是0.1393nm。这种具有6π电子闭合共轭体系,使得苯环具有高度的对称性和特殊的稳定性。由于形成了闭合共轭体系,无单、双键之分,故苯的邻位二元取代物只能有一种。
目前国内、外多采用凯库勒式 键)的式子表示。
二、苯的同系物的异构现象和命名苯的同系物是指苯分子中氢原子被烃基取代的衍生物。当苯环上只有一个取代基时,可以苯环为母体命名,烷基作取代基。若侧链为不饱和烃基(如烯基或炔基)等,则以不饱和烃为母体命名,苯环(苯基)作为取代基。例如:
当苯环上有两个取代基时,则有三种位置异构体。两个取代基的相对位置,可用邻(o)、对(p)和间(m)或数字表示。
当苯环上有三个或三个以上取代基时,它们的位置用数字表示。
芳香烃分子中的一个氢原子被去掉后,所余下的原子团称为芳基,常用Ar表示。例如:
三、苯及其同系物的性质(一)物理性质 苯和它的常见同系物一般为无色的液体,不溶于水,易溶于有机溶剂。相对密度0.8-0.9。芳香烃一般都有毒性。液体芳香烃常用作有机溶剂。苯及其同系物的物理常数见表12-2。 表12-2 苯的同系物
(二)化学性质 由于苯及同系物分子中都含有苯环,故它们的化学性质与饱和烃具有明显的不同,具有特殊的“芳香性”。主要表现在取代、加成和氧化反应上,其中以取代反应为重要。 1.取代反应 在一定条件下,苯环上的氢原子易被其它的原子或原子团取代。 (1)卤代反应:在铁粉或卤化铁的催化下,氯或溴原子可取代苯环上的氢,主要生成氯苯或溴苯。
在同样的催化剂存在时,苯的同系物与卤素的反应比苯容易。一烷基苯与卤素反应主要是卤素取代烷基的邻位或对位上的氢原子。
如果不用催化剂,而是在日光或加热的条件下甲苯与氯气反应,则取代不是发生在苯环上,而是发生在侧链上,即甲基上的氢逐个地被氧化(自由基取代)。
每步反应都有氯化氢身生成。如果控制氯气的量,可以使反应停止在生成氯化芐的阶段。 在光照下,乙苯与氯的反应得到一个混合物。一般说来,在进行自由基卤代时,α-H比β-H容易被取代。乙苯与溴在日光下反应时,α-溴乙苯几乎是唯一产物,表明了自由基溴代时,溴对不同氢原子取代的选择性。
(2)硝化反应苯与浓硝酸及浓硫酸的混合物(混热)共热后,苯环上的氢原子被硝基(-NO2)取代,生成硝基苯。
在有机化合物分子中引入硝基的反应叫做硝化反应。 硝基苯不易继续硝化。如果用发烟硝酸和浓硫酸在95℃时,硝基苯可转变为间二硝基苯。
所以当苯环上带有硝基时,再引入第二个硝基到苯环上就比较困难;或者说,硝基苯进行硝化反应比苯要难。此外,第二个硝基主要是进入苯环上原有硝基的间位。 苯的同系物发生硝化反应时比苯要容易。硝基主要进入烷基的邻位及对位。
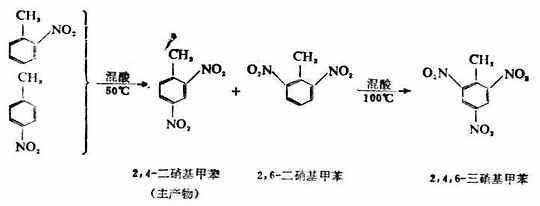
如果反应温度为50℃时,邻及对硝基甲苯继续硝化,主要得2,4-二硝基甲苯,后者在100℃时进一步反应,生成2,4,6-三硝基甲苯(INT),它是一种重要的炸药。
(3)磺化反应 苯与浓硫酸在75-80℃或发烟硫酸(SO3+浓H2SO4)在40℃时反应。苯环上的氢原子被磺酸基(-SO3H)取代,生成苯磺酸。
在有机化合物分子中引入磺酸基的反应叫做磺化反应。 苯磺酸继续磺化时,需要用发烟硫酸及较高温度,产生主要为间苯二磺酸。可见,苯环上已有了磺基后,再引入第二个磺基时比苯要难,而且第二个磺基主要进入原来磺基的间位。
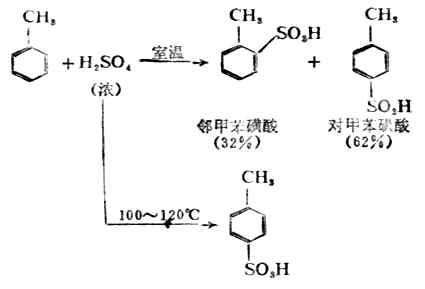
苯的同系物的磺化反应比苯容易进行。例如,甲苯与浓硫酸在常温下即可发发生碘化反应,主要产生是邻及对苯磺酸。如在100-120℃时反应,则对甲苯酸为主要产生。
碘酸是有机强酸,易溶于水,其酸性可与无机强酸相比。 (4)傅-克反应:芳香烃在无水ALCL3作用下,环上的氢原子也能被烷基和酰基所取代。这是一个制备烷基烃和芳香酮的方法,称为傅瑞德尔-克拉夫慈反应,简称傅-克反应。 ① 烷基化反应
② 酰化反应:
常用的酰基化试剂是酰卤,此外还可以用酸酐。
2.氧化反应 苯环本身很稳定,在一般情况下难以氧化。苯的同系物则能与一些氧化剂(如重铬酸钾的酸性溶液、高锰酸钾溶液)反应。这时,苯环的侧链被氧化,只要侧链上有α-H,无论侧链烷基长短如何,都被氧化为与苯相连的羧基。
叔丁基苯不含α-H,在上述条件下不被氧化。
在剧烈的条件下和催化剂存在时,苯环才被破坏。例如:
3.加成反应 环苯在一般条件下不容易发生加成反应。当在催化剂、高温或光的影响下,也可加成。
溴与苯可进行类似反应。 苯的同系物与卤素在日光下,不发生加成反应,而是在侧链上取代。
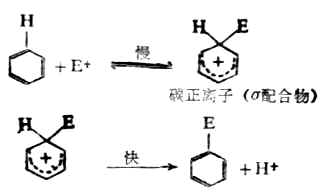
四、苯环上亲电取代反应的历程苯及其同系物在苯环上的取代反应,包括卤化、硝化、磺化、烷基化及酰化等,是一个带正电荷的原子或原子团(E+)首先进攻苯环而进行的反应,故是一个亲电取代。它的整个过程用下式表示。
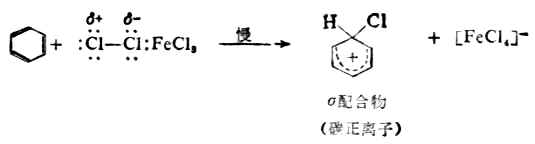
(一)卤化 苯与卤素在催化剂(例如FeCL3)存在下的卤化,是由亲电试剂发动进攻的。这个反应的亲电试剂与卤化铁生成的配合物。
取代反应分两步进行。 第一步,亲电试剂进攻苯环的π电子与CL+生成C-CL键被亲电试剂进攻的碳原子变为sp3杂化,而破坏了原来的环状共轭体系。环上其余的五个sp2杂化的碳原子组成了一个共轭体系,这个体系包括五个碳和四个π电子,它带一个正电荷,连同环上的一个sp3碳原子构成σ配合物。
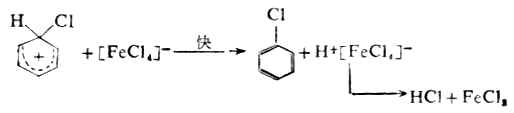
第二步,中间体碳正离子脱去一个质子,生成取代产物。
第一步是决定反应速率的一步,它是由亲电试剂对底物进攻,与烯烃的亲电加成的第一步相似。但在这里整个反应是取代,所以叫做亲电取代。第二步不同于烯烃的是从碳正离子脱去质子,而不是碳正离子与阴离子的结合,这是由于苯环比较稳定的缘故。 催化剂氯化铁促进氯分子极化,并与带负电荷的部分配合,使氯的亲电性加强。如果苯环上有强的活化基团,如羧基,卤化反应可不需加卤化铁。 (二)硝化 苯及同系物硝化反应的亲电试剂是硝金翁离子( )。在混酸中,它 是由浓硝酸与浓硫酸作用生成的。
硝金翁离子O=→O是很强的亲电试剂。 在有些情况下,硝化反应不用混酸而用硝酸。这时的硝金翁离子是通过下式生成的:
(三)磺化 苯及同系物磺化时,进攻试剂是亲电的三氧化硫。
三氧化硫是电中性的分子,但它发生极化:
磺化反应可能分三步进行。 第一步,亲电试剂SO3的进攻,与苯生成σ配合物。这个σ配合物作为一个整体不带电荷,但环中的五个sp2碳及-SO-3两部分分别带一个正电荷信一个负电荷。
第二步和第三步转变为苯磺酸。
(四)傅-克反应 傅-克反应历程和硝化反应历程相似。 1.烷基化 亲电试剂是碳正离子R+,它是由以下过程生成的。 R-X+AlCl3→R++[AlCl3X]- 烷基化由以下两步进行: 第一步:
第二步:
2.酰基化: 亲电试剂是正离子 ,它是由以下过程生成的。
酰基化由以下两步进行: 第一步:
第二步:
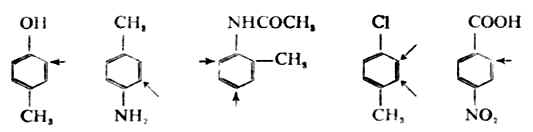
五、苯环上亲电取代的定位规律实验证明当苯环上已经有一个取代基存在,再引入第二个取代基时,则第二个取代基进入的位置和难易程度主要决定于原有取代基的性质,而与进入的取代基关系较少。这应是苯环亲电取代的定位规律。因此,把苯环上已有的取代基叫做定位取代基。根据许多实验事实,可以把定位取代基分为两类。 (一)、邻、对位定取代基 当苯环上已带有这类定位取代基时,再引入的其它基团主要进入它的邻位或对位,而且第二个取代基的进入一般比没有这个取代基(即苯)时容易,或者说这取代基使苯环活化。下面是常见的邻、对位定位取代基。它们的定位取代效应按下列次序而渐减。
这类定位取代基的特征是,取代基中直接与苯环相连的原子大多数是未共用电子对或不含饱和键(但有例外,如-CH=CHCO2是邻、对位定位取代基)。 (二)间位定位取代基 当苯环上已存在这类定位取代基时,再引入的其它基团主要进入它的间位,而且第二个取代基的进入比苯要难,或者说这个取代基使苯环钝化。下面是常见的间位定位取代基,它们的定位效应按下列次序而渐减。
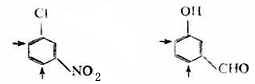
这类定位取代基的特征是,取代基中直接与苯环相连的原子一般都含有不饱和键或带有正电荷。 苯环的取代规律在实际应用上很有意义,因为掌握了这个规律,就可以预知取代反应中的主要产物。 取代定位规律并不是绝对的。实际上在生成邻位及对位产物的同时,也有少量间产物生成;在生成间位产物的同时,也有少量的邻位和对位产物生成。例如当甲苯在0℃下磺化时,除生成52.5%的对甲基磺酸和42.7%的邻甲基苯磺酸外,还生成3.8%的间甲基苯磺酸。 (三)二取代苯的取代定位规律 如果苯环上已经有了两个取代基,当引入第三个取代基时,影响第三个取代基进入的位置的因素较多。定性地说,两个取代基对反应活性的影响有加和性。人们从实际工作中得出了以下的经验规律: 1.苯环上已有两个邻对位定位取代基或两个间位定位取代基,当这两上定位取代基的定位方向有矛盾时,第三个取代基进入的位置,主要由定位作用较强的一个来决定。如果两上定位取代基的作用强度相近,将得到数量相近的异构体。例如,下列化合物进行亲电取代反应时,第三个取代基主要进入的位置用“→”表示。
2.苯环上已有一个邻对位定位取代基和一个间位定位取代基,且二者的定位方向相反,这时主要由邻对位定位取代基来决定第三个取代基进入的位置。例如:
3.两个定位取代基在苯环的1位和3位时,由于空间位阻的关系,第三个取代基在2位发生取代反应的比例较小。例如:
六、苯及其主要同系物(一)苯 苯为无色液体,具有特殊气味,易燃烧。熔点5.5℃,沸点80℃。不溶于水,易溶于有机溶剂。苯有毒性,可致癌。 苯是重要的化工原料,也是优良的有机溶剂。 (二)甲苯 甲苯为无色液体,易燃烧,挥发性强。甲苯主要用以合成硝基甲苯、TNT、苯甲酸、苯甲醛等。甲苯也用作溶剂。 (三)二甲苯 二甲苯有三种异构体(邻、间、对位)。三种异构体的混合物为无色液体,易燃。不溶于水,易溶于有机溶剂。二甲苯在医学上制作组织切片标本时,用于脱醇、脱脂、二甲苯也是一种重要的有机合成原料。
|








 ,但不要理解为苯分子中存在单键和双键,另一种表示方法是用正六边形碳环中画一圆圈
,但不要理解为苯分子中存在单键和双键,另一种表示方法是用正六边形碳环中画一圆圈 (代表环状共轭π
(代表环状共轭π