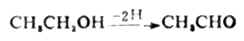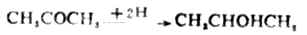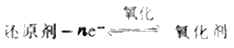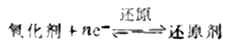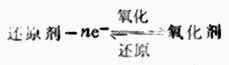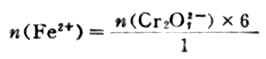|
《医用化学》 > 第六章 氧化还原与电极电位
第一节 氧化还原
一、氧化还原的概念(一)元素的氧化数 元素的氧化素是指分子中各原子所表现出来的形式电荷数。确定元素氧化数的原则是: 1.在单质的氧化数为零。 2.在简单离子中,元素的氧化数等于该离子所带的电荷数。例如,Na+中Na的氧化数为+1,S2-中S的氧化数为-2。 3.氧在化合物中的氧化数为-2(过氧化物如H2O2中,氧的氧化数为-1,氢在化合物中的氧化数为+1,(金属氢化物如CaH2中,氢的氧化数为-1)。 4.分子中各元素氧化数的代数和等于零。 在离子化合物中元素的氧化数和它的化合价是一致的;在共价化合物中元素的氧化数与它的共价有所不同。氧化数有正、负之分,而共价则无正、负。元素的化合价只能是整数,而元素的氧化数可是整数彵可是分数。 例1:求Na2S4O6中S的氧化数。 解:设Na2S4O6中S的氧化数为x: 2×1+4x+6×(-2)=0 4x=10 x=+(5/2) 即Na2S4O6中S的氧化数为+(5/2)。 (二)氧化还原的概念 在化学发展的初期,氧化是指物质与氧化合的过程,还原是指物质失去氧的过程。例如,汞与氧化合生成的氧化汞时,汞被氧化生成氧化汞。 2Hg+O2→2HgO 相反地,当氧化汞加热分解成汞和氧时,氧化汞失去氧被还原成汞。 2HgO→2Hg+O2 以后氧化还原的概念扩大了,认为物质失去氢的过程也是氧化,与氢结合的过程则是还原。这种去氢氧化(即脱氢氧化),加氢还原的概念,在有机化学和生物化学中应用较为广泛。例如,乙醇脱氢被氧化成乙醛。
丙酮加氢被还原成异丙醇。
然而,这些概念不能应用到没有氢和氧参加的氧化还原反应上,也没有指出氧化还原反应的实质。 现在认为,氧化还原反应的特征是在反应前后某些元素的氧化数有了改变,其实质是物质之间有电子的得失。因此,有些反应虽然没有氧或氢参加,但由于有氧化数的改变,即有电子的得失,所以也是氧化还原反应。例如,锌与铜离子的反应。 Zn+Cu2+→Zn2+Cu 反应中,每个锌原子失去两个电子,变为锌离子,氧化数由零升高到+2,锌被氧化是还原剂;每个铜离子接受两个电子,变为铜,氧化数由+2降低到零,铜离子被还原是氧化剂。 Zn-2e-→Zn2+ (氧化反应) Cu2++2e-→Cu (氧化反应) 我们把物质失去电子(元素的氧化数升高)的过程称为氧化;物质得到电子(元素的氧化数降低)的过程称为还原。在任何化学反应中,若有得到电子的物质,必然有失去电子的物质,且得失电子总数相等,因而氧化与还原必定同时发生。
二、氧化剂与还原剂的共轭关系在氧化还原反应中,还原剂被氧 化,生成与之共轭的氧化剂。
同理,在氧化还原反应中,氧化剂被还原,生成与之共轭的还原剂。
因此,氧化剂与还原剂的共轭关系可用下式表示:
一种还原剂要失去电子表现出可被氧化的性质,只有在能得到电子可被还原的另一种氧化剂的存在下才能实现,即
例如,在 Zn +Cu2+=Cu+Zn2+反应中,还原剂1Z失去电子,氧化数升高,其产物为氧化化剂1Zn2+;氧化剂2Cu2+得到电子,氧化数降低,其产物为还原剂2Cu。这样Zn与Zn2+,Cu2+与 Cu构成了如下两个共轭的氧化还原电对: Zn2+/Zn Cu2+/Cu (氧化剂)(还原剂) (氧化剂)(还原剂) 在氧化还原电对中,氧化数高的物质为氧化型物质,氧化数低的物质为还原型物质。如果还原剂越强(失去电子的能力越大),则其共轭的氧化剂越弱(得到电子的能力越小);如果氧化剂越强,则其共轭的还原剂越弱。例如,在MnO-4/Mn2+电对中,MnO4是一个强氧化剂,Mn2+是一个弱还原剂。氧化还原反应是按较强的氧化剂和较强的还原剂相互作用方向进行的。
三、氧化还反应的计量关系在氧化还原反应中,氧化剂与还原剂之间是按一定化学计量关系相互作用的。对于任何一个氧化还原反应: aA+bB===dD+eE 当反应达到化学计量点时,amol(氧化剂)恰与bmol(还原剂)完全作用,也就是说对于一个能定量进行的氧化还原反应,化学反应方程式中氧化剂与还原剂物质的系数比,就是反应中氧化剂与还原剂相互作用的物质的量之比,即 nA:nB=a:b (6-1) 如果已知氧化剂或还原剂物质的量,通过上式可以计算出还原剂或氧化剂物质的量。例如,2KMnO4+5H2O2+3H2SO4====2MnSO4+K2SO4+8H2O+5O2 从反应式中知,2mol KMnO4与5mol H2O2完全作用,若已知KMnO4物质的量,可以求出H2O 2物质的量。
又如,Cr2O2-7+6Fe2++14H+=2Cr3++6Fe3++7H2O,从反应中知,Cr2O2-7与Fe2+反应的物质的量之比为1/6,即有
若已知Cr2O2-7物质的量,可求出Fe2+物质的量。
…… 第一节 配合物的基本概念 第二节 配合物的配位键理论 第三节 配合物的稳定性 第四节 螯合物(内络合物) 第六章 氧化还原与电极电位 第一节 氧化还原(当前页) 第二节 电极电位 第三节 电极电位的应用 第七章 滴定分析 第一节 滴定分析概念 …… |